Patch-seq是一种结合了膜片钳记录技术(patch-clamp electrophysiology)、单细胞转录组测序(single-cell RNA sequencing)和形态学分析的新兴技术。这种方法能够在同一个细胞中同时获得电生理特性、基因表达数据和形态学特征。

2020年在细胞代谢期刊上发表了题为《Patch-Seq Links Single-Cell Transcriptomes to Human Islet Dysfunction in Diabetes 》的研究论文,其中使用了Patch-seq技术。
文章摘要:
胰岛细胞功能受损是人类代谢失调和疾病的主要原因。尽管如此,将胰岛细胞的生理功能障碍与基因表达的精确变化直接联系起来仍然具有挑战性。在这里,我们展示了单细胞 RNA 测序与胞吐作用和通道活性的电生理学测量 (patch-seq) 相结合,可用于在单细胞水平上将内分泌生理学和转录组联系起来。我们从 34 名患有或未患有糖尿病的人类捐赠者的胰腺中收集了 1,369 个 patch-seq 细胞。对功能和基因表达网络的分析确定了与 β 细胞功能异质性相关的基因组,可用于预测电生理学。我们还报告了 2 型糖尿病功能障碍的转录程序,并将这种方法扩展到来自 1 型糖尿病捐献者的冷冻保存细胞,为了解健康和疾病中的胰岛细胞异质性提供了宝贵的资源。
背景介绍
细胞利用胞吐作用分泌多种分子,包括蛋白质、激素和神经递质。从胰腺中的胰岛细胞到生殖系统中的滤泡细胞,内分泌细胞分泌调节新陈代谢、生长和发育的激素。通过使用膜片钳电生理学来测量囊泡与细胞膜融合并释放其内容物时膜电容的变化,可以在单细胞水平上监测胞吐作用。了解胞吐作用等动态生理过程与细胞转录组通常较慢的变化之间的联系非常有趣,转录组反映了细胞的基因表达和基因组调控过程。单细胞 RNA 测序 (scRNA-seq) 使我们能够分析单个细胞的分子身份并检测病理环境中出现的基因表达变化。这项技术根据不同器官的转录指纹提供了越来越准确的细胞类型分类。然而,将细胞的生理特性直接归因于其测量的转录组表型,并与疾病中的细胞功能障碍建立明确的联系仍然具有挑战性。
朗格汉斯(Langerhans)胰岛通过调节两种主要葡萄糖调节激素胰岛素和胰高血糖素的胞吐作用来控制体内循环葡萄糖水平。几项单细胞基因组学研究揭示了胰岛细胞类型之间的显着变异,以及转录上不同的细胞亚群的存在。这种异质性已通过表面标记和质谱特征的鉴定得到证实。先前的精液生理学研究表明,胰岛细胞,尤其是产生胰岛素的 β 细胞,具有异质性功能。 而 β 细胞功能受损和胞吐作用减少是早期 2 型糖尿病 (T2D) 的标志特征。然而,将胰岛细胞分子异质性与此类生理特性直接联系起来的能力仍然有限。。此外,T2D 中上调或下调的基因之间的联系对胰岛功能的影响仍不清楚,而且我们对全基因组关联研究确定的 T2D“风险”候选基因的机制理解仍然存在重大差距。
为了解决这些限制,我们在这里结合使用全细胞膜片钳测量和 scRNA-seq,统称为 patch-seq。在分散的胰岛细胞中。这种方法使我们能够同时测量人类内分泌细胞的细胞功能和转录组,使我们能够将基因表达与囊泡胞吐作用和离子通道活性的定量生理测量联系起来。我们从 28 名没有糖尿病 (ND) 或患有 T2D 的捐赠者(大多数病程较短)收集了 1,021 个 patch-seq 细胞,并剖析了不同胰岛细胞类型的功能与基因表达关系。我们发现了 484 个基因的子集,可以预测多种 β 细胞电生理表型,并通过遗传功能丧失实验验证了假定的新型 β 细胞生理调节因子。我们还鉴定了与 T2D 捐献者的 β 细胞胞吐作用减少相关的途径,并发现这些途径与在非糖尿病捐献者中观察到的不同。与非糖尿病供体的 β 细胞相比,我们还在 2 型糖尿病患者的 β 细胞中发现了与高胞吐作用表型相关的基因上调,并提出了 2 型糖尿病期间 β 细胞生理功能障碍的遗传机制。例如,我们发现转录因子 ETV1 可能在患有 T2D 的人类 β 细胞功能障碍中发挥重要作用。最后,我们证明我们的方法也可以应用于冷冻保存的人类胰岛样本。使用来自 T1D 捐献者的稀有冷冻胰岛的 348 个细胞,我们获得了 α、γ、δ、导管和存活 β 细胞的概况。 我们的工作在单细胞水平上绘制了胰岛细胞功能及其转录组图谱,为探索健康和疾病中的胰岛生理和遗传功能障碍提供了宝贵的资源。
Patch-Seq 同时评估内分泌细胞中的生理学和转录组
为了在单个人类胰岛细胞中实现膜片钳,然后进行 scRNA-seq (patch-seq),我们最初从 28 名捐赠者中分离出细胞,其中 18 名没有糖尿病 (ND),7 名患有 T2D,以及另外 3 名被排除在外的捐赠者。我们将 patch-seq 建立为一个两步过程:(1)我们使用全细胞膜片钳进行电生理学测量,(2)在“磨合”后 5 分钟内,我们使用更大的辅助移液器填充细胞内容物使用裂解缓冲液。这允许在细胞内进行全细胞记录和胞吐作用测量,然后使用 Smart-seq2 恢复全长转录组,测序深度为 1-200 万个读数。总共 1,021 个细胞 (80%) 通过了电生理学和测序的质量控制,并根据 tSNE 投影中关键标记基因的表达分为主要细胞类型。我们获得了所有主要胰岛细胞类型(α、β、δ 和 γ 细胞)和非胰岛类型(例如腺泡细胞)的代表。对于每个细胞,我们测量了代表细胞大小、胞吐作用、Na +通道电流和 Ca 2+通道电流的参数。因此,我们对 ND 和 T2D 环境中所有主要胰岛细胞类型的电生理活性进行了广泛的调查。 除了通过全细胞电容测量的预期细胞类型大小差异之外,这些数据还表明不同胰腺细胞类型和疾病状态的胞吐作用和通道活性存在显着差异,包括两种细胞的胞吐功能的改变和 T2D 中的 β 细胞。

图 1内分泌细胞中的 Patch-Seq 测量
(A) patch-seq 示意图。 (B) patch-seq 细胞通过过度分散的基因表达而聚集的 tSNE 投影。
(C) 每个细胞的细胞大小(作为膜电容)和关键标记基因的表达。颜色代码如 (B) 所示。虚线表示每种细胞类型的平均值。 (D) 本研究中收集的 Patch-seq 细胞。 (E) 在每个细胞中,我们测量了以下内容:a,早期胞吐作用; b、晚期胞吐作用; c、Ca 2+积分; d、总胞吐作用; e、Na +电流半失活; f,峰值Na +电流; g、早期Ca 2+电流; h,晚期Ca 2+电流(未显示:细胞大小、标准化为Ca 2+的胞吐作用、反转电位以及Na +和Ca 2+电导)。(F) 选定参数的分布,证明 α(红色)和 β(黑色)细胞的功能异质性。插入字母 (a–h) 对应于 (E) 中的参数。 1 mM 葡萄糖(α 细胞)或 5–10 mM 葡萄糖(β 细胞)时 a 和 d 中胞吐反应的分布。
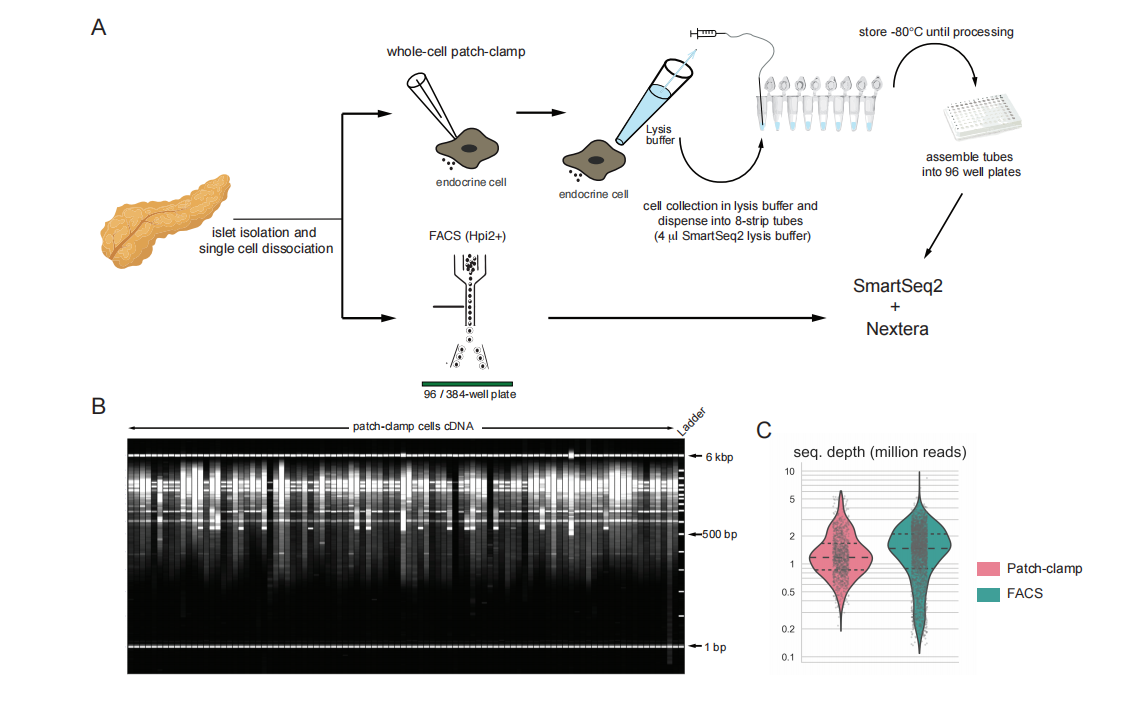
补充图S1–跨细胞类型和疾病的内分泌细胞中的Patch-seq测量值。
(A)以96孔(patch-seq)和384孔(FACS)形式从相同供体获得细胞的patch-seq管道的方案。
(B)显示cDNA大小分布的片段分析仪图像从文库制备后的patch-seq细胞中获得(SmartSeq2)。
(C)显示顺序的小提琴图在此数据集中获得的patch-seq和FACS单元的深度(约100万次读取/单元)。
文献原文:https://www.cell.com/cell-metabolism/fulltext/S1550-4131(20)30187-X
Patch-seq的关键步骤:
- 1. 膜片钳记录:首先,通过膜片钳记录获得单个细胞的电生理数据,包括电压和电流的变化,进而推测细胞的功能特性,如动作电位的发放频率、膜电阻等。这部分数据帮助研究细胞的生理功能。
- 2. 细胞的提取与裂解:在完成膜片钳记录后,通过电极吸取细胞内容物,确保单细胞被完整地收集。该步骤可以在不损伤细胞的情况下将细胞中的RNA提取出来。
- 3. 单细胞转录组测序:收集的细胞内容物会经过单细胞RNA测序,生成该细胞的基因表达谱。这帮助研究细胞的分子特征和基因表达状态。
- 4. 形态学分析:有时在电生理记录完成后,细胞会用染料标记,以便后续分析它们的形态学特征,如树突或轴突的形状和分支。这对研究神经元细胞尤其重要。
应用:
Patch-seq技术特别适用于神经科学研究,因为神经元具有高度异质性,单凭电生理学或转录组学难以全面揭示它们的功能状态。Patch-seq能够将神经元的功能(电生理)、分子(基因表达)、以及形态学特征结合起来,为分类和功能解析提供更深入的理解。
这种技术可用于:
- • 神经元类型的分类:根据电生理特性和转录组信息更精准地对不同神经元进行分类。
- • 疾病研究:例如研究阿尔茨海默症或癫痫等神经系统疾病时,可以结合细胞的电生理异常和基因表达差异,深入理解病理机制。
- • 药物开发:通过分析药物对单细胞功能和基因表达的影响,筛选出潜在的药物靶点。
Patch-seq技术的主要优势在于能够在单细胞层次上多角度表征细胞特性,但技术要求较高,需要熟练的实验技巧和高度优化的实验流程。
- 本文固定链接: https://maimengkong.com/1784.html
- 转载请注明: : 萌小白 2024年9月2日 于 卖萌控的博客 发表
- 百度已收录