1
为什么要去死细胞
10× Genomics单细胞方案要求使用具有较高活性的单细胞悬液。在实际实验中,因为样本类型和制备单细胞悬液方法的不同,容易出现单细胞悬液中死亡细胞的比例较高的情况。去除单细胞悬液中的死细胞和其他污染物对获得高质量数据是至关重要的。这是因为,死亡的细胞易裂解导致其中的RNA释放出来。这种cell-free RNA会导致检测的背景噪声,并会影响单细胞数据的质量。下文我们会举例说明死细胞去除前后对单细胞测序数据的影响。
2
什么情况下去死细胞
10× Genomics官方建议,当单细胞悬液活性低于70%时应做去除死细胞操作,并推荐使用MACS® Dead Cell Removal Kit(Miltenyi Biotec)。需要注意到,去除死细胞的操作会损失一定的细胞数量,目前10× Genomics和Miltenyi Biotec都没有给出单细胞悬液含有多少细胞数量才建议做去除死细胞的操作。基于我们的单细胞测序实验经验,建议单细胞悬液中的细胞数量不小于30万个时可以做去除死细胞的操作。
3
去除死细胞对单细胞数据会有多大提升
10× Genomics公司做过一个测试实验,他们使用的单细胞悬液来自健康人的外周血单核细胞 (PBMC)。然后将单细胞悬液分成4组进行进一步处理。
1)Control,单细胞悬液制备后立即进行细胞上机
2)24 h at RT,室温下在PBS中放置24h的细胞
3)Digitonin Low,用5 ng/mL Digitonin处理单细胞悬液。使细胞悬液的活细胞 <5%,并以1:1的比例与>90%的活 PBMC混合
4)Digitonin High,用5 ng/mL Digitonin处理单细胞悬液。使细胞悬液的活细胞 <5%,并以5:1的比例与>90%的活PBMC混合
PBMC在室温下长时间孵育将导致细胞死亡增加。Digitonin会透过细胞膜,模拟类似非活性细胞的表型,在细胞凋亡时过早溶解。
为检测每个细胞组的细胞活性,用台盼蓝染色细胞并用细胞计数仪计算细胞数量(表1)。作为对比,使用MACS® Dead Cell Removal Kit(Miltenyi Biotec)去除4个细胞组中的死细胞。去除死细胞后,再次评估每个PBMC组的细胞活性(表1)。
表1 各个PBMC悬液的细胞活性比较
接下来,对每个PBMC组制备了单细胞转录组测序文库(分别为去除死细胞处理前(Pre-DCR)和后(Post-DCR))。所有8个文库采用PE测序模式进行测序,每个细胞大约有90,000个reads,然后使用Cell Ranger™ 2.0对数据分析。
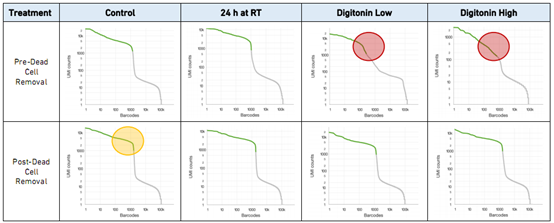
图 1 各个细胞组的Barcode Rank Plots
图1显示8份样本在死细胞去除前后的Barcode Rank Plots,展示了Barcode数量(x轴)与相应的总UMI数量(y轴)的分布。包含细胞的区域显示为绿色,背景区显示为灰色。红色圆圈表示没有出现陡降。黄色圆圈是表示出现明显陡降的示例。陡降表示细胞相关的绿色区域和背景灰色区域具有良好的分离。此外,良好的分离表明样本中存在少量的细胞外环境RNA。环境RNA所占部分高通常是由于非活性细胞在单细胞分选前或过程中过早地出现了裂解。Digitonin Low和Digitonin High样本未经Dead Cell Removal kit处理(分别为50%和 20%活细胞)缺乏良好的分离,提示存在更多的背景区域。
3.1去除死细胞后样品清洁度增加
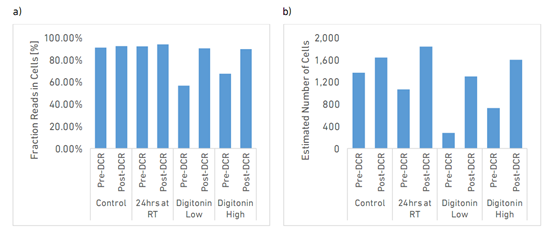
图2 去除死细胞处理前后8个样本的Fraction Reads in Cells和Estimated Number of Cells指标比较
图2a和2b分别显示了各样本的Fraction Reads in Cells(细胞中的片段读数)和Estimated Number of Cells(估计细胞数量)。Fraction Reads in Cells是与细胞barcode相关的确信的mapped reads所占百分比。用Digitonin处理的样本在去除死细胞之前显示出最低的Fraction Reads in Cells (~56-67%),表明更高百分比的Reads与背景区相关(barcodes与细胞无关)。去除死细胞后,每份样本的Fraction Reads in Cells增加至> 80%。
3.2去除死细胞后增加了捕获细胞计数的准确性
本项测试,设计捕获每个样本1500个细胞。图1中绿色线对应的x轴Barcode数量即为Estimated Number of Cells。从图2b可以看到,control样本和做过去死细胞处理的样本的Estimated Number of Cells与捕获1500个细胞紧密匹配。相比之下,室温放置24h或用Digitonin处理的样本的捕获细胞数量低于预期(24 h RT:1066个细胞,Digitonin Low:278个细胞,Digitonin High:730个细胞)。
3.3去除死细胞后增加了文库复杂性
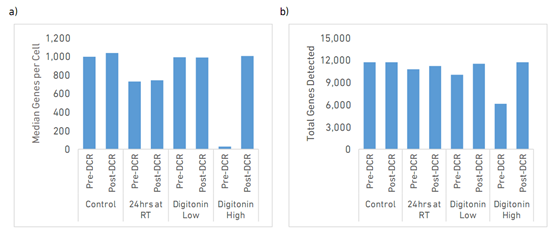
图3 去除死细胞处理前后8个样本的Median Genes per Cell和Total Genes Detected指标比较
图3显示了每个样本的Median Genes per Cell(每个细胞的中位基因数)(a)和Total Genes Detected(总检测基因数)(b)。Median Genes per Cell在所有样本中保持相对一致 (~1,000),Digitonin High样本除外。对于含20%活细胞的Digitonin High样本Pre-DCR,仅检测到每个细胞27个中位基因。去除死细胞后文库的复杂度显著提高,达到了每个细胞>1000个基因的中位数。有趣的是,室温放置24小时的样本显示了文库复杂度的降低,而进行去除死细胞处理仍无法恢复。
3.4去除死细胞后线粒体基因数量减少
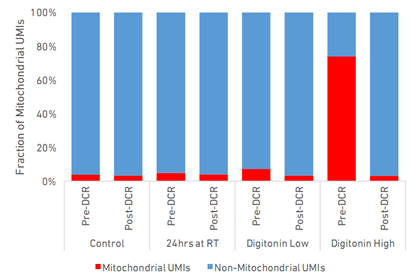
图4 每份PBMC样本中线粒体UMI的占比
线粒体是参与细胞凋亡启动和执行的主要细胞器之一。细胞凋亡过程依赖于一系列信号级联反应,包括线粒体基因表达增加和半胱天冬酶激活。因此对每个样本中线粒体基因来源的UMI数量进行了评估(图4)。在质量较高、活细胞> 80%的样本中,仅检测到低比例的线粒体 UMI (~3%)。正如预期的那样,仅含有20%活细胞的Digitonin High 样本中线粒体转录本数量最高(74%)。相比之下,含有50%活细胞的样本仅显示线粒体基因表达轻微增加(5-7%),表明细胞活性确实与观察到的线粒体转录本数量相关。
3.5去除死细胞后大部分样本都能鉴定出主要细胞亚型
细胞聚类分析可以更直观地展示死细胞去除前后的8个样本细胞聚类的变化。发现大多数样本的聚类相似,共确定出14个子聚类(图5至8)。除了在室温下放置24小时的样本外,可以清晰地鉴定出PBMC样本中的所有主要细胞亚型,这些PBMC样本已经用死细胞去除试剂盒处理过,并含有> 80%的活细胞。在室温下放置24小时的PBMC样本中,单核细胞亚群几乎不存在,表明大多数细胞已丧失CD14标记物表达(图 6)。此外,尽管在去除死细胞之后,该样本中识别出了所有其他主要的PBMC亚型,但亚型的聚类与其他样本不同。相反地,根据标记基因表达,在低质量(< 50%活性)的样本中,出现亚群不存在或是由显著较少的细胞代表(图7、8)。未能在细胞活性最低的样本中鉴定出任何主要的PBMC亚型(Digitonin High Pre-DCR,20%活细胞)。

图5 Control样本聚类分析

图6 24 h at RT样本聚类分析
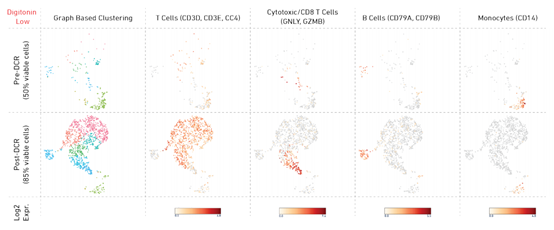
图7 Digitonin Low样本聚类分析

图8 Digitonin High样本聚类分析
4
怎么去死细胞
我们采用10× Genomics推荐的MACS® Dead Cell Removal Kit(Miltenyi Biotec)(Order no: 130-090-101)对低活性的单细胞悬液进行去除死细胞处理(图9)。Dead Cell Removal Kit包含现成可用的MicroBeads(微珠)和用于细胞碎片、死亡细胞和正在死亡细胞的磁标记的结合缓冲液。微珠会识别凋亡以及死亡细胞质膜中的抗原。在采用Dead Cell Removal Kit去除死细胞时,死细胞会被微珠磁性标记,并通过分离柱。磁性标记的死细胞会保留在柱子上,而未标记的活细胞会从流出液中收集起来(图10)。使用Dead Cell Removal Kit,即使是具有完整细胞膜的早期凋亡细胞也会被去除。
Dead Cell Removal Kit规格
MScolumns(1×10 4 – 1×10 7 labeled cells in 1×10 4 – 2×10 8 totalcells)(单细胞实验)
LScolumns(1×10 5 – 1×10 8 labeled cells in 1×10 7 – 2×10 9 totalcells)
所需仪器
Magneticcell separators MiniMACS™, MidiMACS™, VarioMACS™或是SuperMACS™.
MACSColumn(s) MS或是LS (plus MS或是LS adapter for use in combination with VarioMACS or SuperMACS).
可在https://www.miltenyibiotec.com查询详情
图9 Dead Cell Removal Kit

图10 使用Dead Cell Removal Kit去除死细胞
参考文献
-
https://support.10xgenomics.com/single-cell-gene-expression/sample-prep/doc/demonstrated-protocol-removal-of-dead-cells-from-single-cell-suspensions-for-single-cell-rna-sequencing
-
https://support.10xgenomics.com/single-cell-gene-expression/sample-prep/doc/technical-note-removal-of-dead-cells-from-single-cell-suspensions-improves-performance-for-10x-genomics-single-cell-applications
-
https://www.miltenyibiotec.com/CN-en/products/macs-sample-preparation/removal-reagents/dead-cell-removal-kit.html#130-090-101
- 本文固定链接: https://maimengkong.com/zu/1515.html
- 转载请注明: : 萌小白 2023年5月3日 于 卖萌控的博客 发表
- 百度已收录
