上一篇文章《肿瘤变异数据分析和可视化工具maftools:突变数据下载和可视化》主要以TCGA-LUAD为例介绍突变数据和临床数据的下载、处理以及简单的可视化。这篇文章更详细介绍可以利用maftools对肿瘤MAF格式的突变数据做哪些分析。
还和上篇一样,先用maftools把数据读入
具体的数据下载和处理方法这里就不再赘述了,请移步上篇文章:《肿瘤变异数据分析和可视化工具maftools:突变数据下载和可视化》。这篇文章里,读入的临床数据终于可以派上用场了。
library(maftools) luad <- read.maf(maf=\"TCGA.LUAD.maf\", clinicalData=\"clinical.tsv\")
突变的互斥性(exclusive)和共现性(Co-occurrence)分析
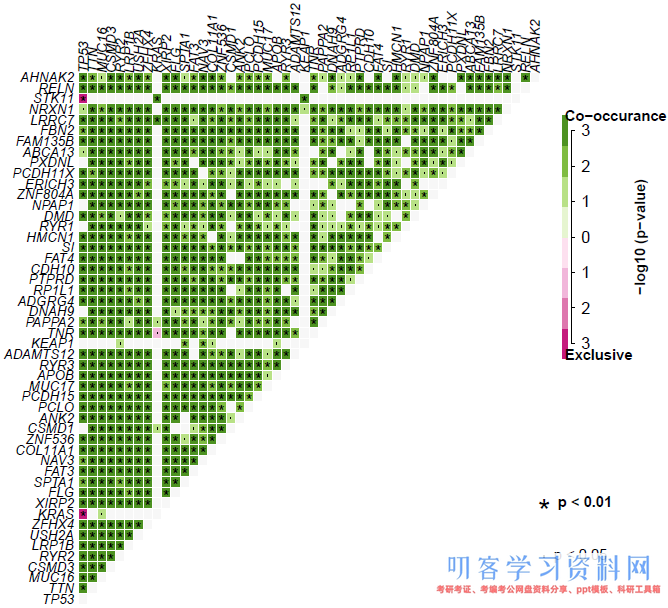
使用函数somaticInteractions可通过对所选突变两两之间进行成对的Fisher精确检验分析突变的互斥性和共现性。此外还通过cometExactTest通过CoMEt检验寻找包含>2基因的互斥基因集。参数top=30用于设定队列中突变最多的30个基因。也可以用参数genes手动设定想要比较的基因列表。pvalue用来设定图中“点”和“星号”标注显著性所对应的阈值。
由于程序原因,直接运行somaticInteractions不能显示成对互斥性和共现性的结果$pairs,需要用一个变量(如下面的output)捕获该函数的返回值并运行两次才能得到$pairs:
> output <- somaticInteractions(maf=luad, top=50, pvalue=c(0.05, 0.01)) # 使用变量捕获函数输出 ## Checking for Gene sets ## ------------------ ## genes: 4 ## geneset size: 3 ## 4 combinations ## Signifcantly altered gene-sets: 1 ## ------------------ > output # 第一次 ## $pairs ## ## $gene_sets ## gene_set pvalue ## 1: TP53, KRAS, STK11 0.04708279 > output # 第二次 ## $pairs ## gene1 gene2 pValue oddsRatio 00 11 01 10 Event ## 1: XIRP2 ZFHX4 1.968494e-14 4.850686 334 80 90 61 Co_Occurance ## 2: MUC16 TTN 3.880676e-14 3.817014 229 146 112 78 Co_Occurance ## 3: LRP1B MUC16 4.388807e-14 4.074352 272 114 110 69 Co_Occurance ## 4: RYR2 LRP1B 6.666331e-14 4.068623 284 107 76 98 Co_Occurance ## 5: TTN RYR2 9.467845e-14 3.835079 238 136 69 122 Co_Occurance ## --- ## 1039: AHNAK2 RP1L1 4.506738e-02 1.853890 415 19 72 59 Co_Occurance ## 1040: ZNF536 SPTA1 4.702016e-02 1.613526 353 35 102 75 Co_Occurance ## 1041: LRRC7 FAT4 4.792946e-02 1.807431 414 19 69 63 Co_Occurance ## 1042: ADGRG4 ADAMTS12 4.907451e-02 1.769172 398 23 76 68 Co_Occurance ## 1043: RELN ADGRG4 4.978755e-02 1.784468 413 19 72 61 Co_Occurance ## ## $gene_sets ## gene_set pvalue ## 1: TP53, KRAS, STK11 0.04708279
本例中共获得1042个显著互斥/共现的突变基因对(Fisher精确检验)以及1个互斥的基因集(CoMEt检验)。注意程序输出的“occurance”存在拼写错误,应为“occurrence”。输出详细结果可以使用write.table写入到文件:
write.table(output$pairs, file=\"somaticInteractions.pairwise.tsv\", quote=FALSE, row.names=FALSE, sep=\"\\t\") write.table(output$gene_sets, file=\"somaticInteractions.comet.tsv\", quote=FALSE, row.names=FALSE, sep=\"\\t\")
生成的图以矩阵的形式展示基因对Fisher精确检验的结果。其中绿色和洋红色分别代表共现和互斥,颜色深浅代表显著性程度-log10(p-value):
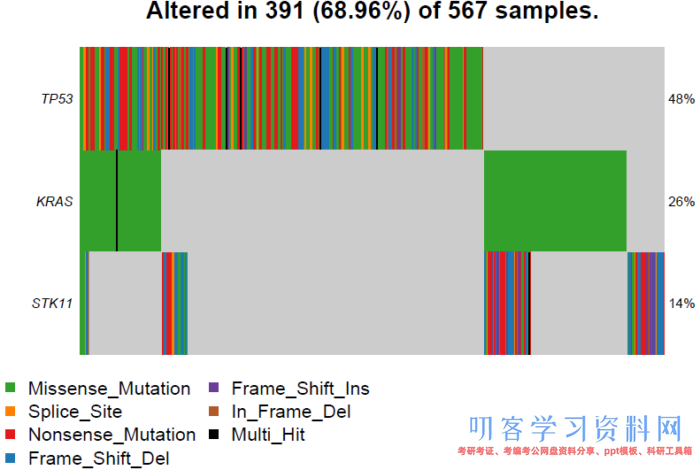
然后可以选择感兴趣的基因,使用oncostrip展示(当然也可以使用oncoplot):
oncostrip(maf=luad, genes=c(\"TP53\", \"KRAS\", \"STK11\"), border=NULL) # 这里选择了exclusive的基因集
预测癌症驱动基因
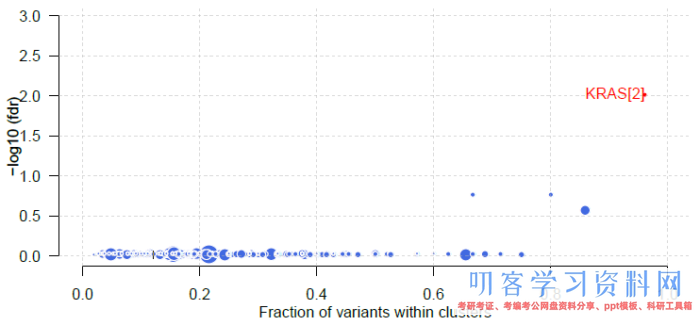
maftools中的函数oncodrive基于“oncodriveCLUST算法”可直接从MAF文件中鉴定癌症驱动基因。其原理是癌症驱动基因的突变通常富集在特定位点(热点):
luad.sig <- oncodrive(maf=luad, minMut=5, AACol=\"HGVSp_Short\", pvalMethod=\"zscore\") # 将统计结果保存到文件 write.table(luad.sig, file=\"luad.oncodrive.tsv\", quote=FALSE, row.names=FALSE, sep=\"\\t\") # 使用plotOncodrive函数绘制散点图 plotOncodrive(res = laml.sig, fdrCutOff = 0.1, useFraction = TRUE)
图中点的大小以及基因名后的数字展示的是基因内突变cluster的数量,X轴为cluster内的突变数量或者占突变总数的比例(根据参数useFraction设定显示方式),Y轴是-log10(fdr)。本例(TCGA-LUAD)中鉴定到的驱动基因candidate为KRAS:
pfam注释和统计
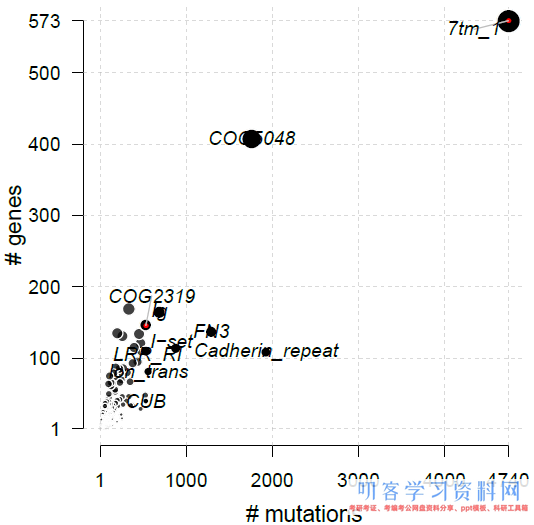
pfamDomains可以用来注释导致氨基酸改变的突变所在pfam结构域以及按照pfam结构域为对象的统计结果(分别储存在luad.pfam$proteinSummary和luad.pfam$domainSummary中),并绘制散点图:
luad.pfam <- pfamDomains(maf=luad, AACol=\"HGVSp_Short\", top=10)
圆点代表pfam结构域,对应X轴为该结构域中出现的突变数量,Y轴以及圆点的大小为影响的基因数。参数top用来选择标记突变数最多的pfam domain数量。
统计结果的展示和保存:
> luad.pfam$proteinSummary[,1:7, with=FALSE] ## HGNC AAPos Variant_Classification N total fraction DomainLabel ## 1: KRAS 12 Missense_Mutation 136 154 0.88311688 COG1100 ## 2: EGFR 858 Missense_Mutation 23 78 0.29487179 PTKc_EGFR ## 3: EGFR 746 In_Frame_Del 17 78 0.21794872 PTKc_EGFR ## 4: TP53 273 Missense_Mutation 10 281 0.03558719 P53 ## 5: TP53 249 Missense_Mutation 10 281 0.03558719 P53 ## --- ## 138224: pk 753 Missense_Mutation 1 6 0.16666667 ## 138225: pk 543 Missense_Mutation 1 6 0.16666667 ## 138226: pk 735 Missense_Mutation 1 6 0.16666667 ## 138227: pk 316 Missense_Mutation 1 6 0.16666667 ## 138228: pk 313 Missense_Mutation 1 6 0.16666667 > luad.pfam$domainSummary[,1:3, with=FALSE] ## DomainLabel nMuts nGenes ## 1: 7tm_1 4740 573 ## 2: Cadherin_repeat 1925 109 ## 3: COG5048 1760 408 ## 4: FN3 1290 138 ## 5: I-set 878 115 ## --- ## 6734: zf-Sec23_Sec24 1 1 ## 6735: zf-ZPR1 1 1 ## 6736: zf-piccolo 1 1 ## 6737: zf-primase 1 1 ## 6738: zf-rbx1 1 1 > write.table(luad.pfam$proteinSummary, file=\"pfam_protsum.tsv\", quote=FALSE, row.names=FALSE, sep=\"\\t\") > write.table(luad.pfam$domainSummary, file=\"pfam_domainsum.tsv\", quote=FALSE, row.names=FALSE, sep=\"\\t\")
泛癌的比较分析
pancanComparison函数可以将给定的队列和21个癌症队列中高频突变的基因(参考文献)进行比较,从而分析给定队列中特异性的突变。做这个分析需要用到MutSigCV的结果。(略,有时间再补充)
生存分析
2020/03/03更新:
- 生存分析这块,maftools的作者可能在几个月前修改过代码,输入参数发生了变化,因此这一部分本问的内容会和最新版不太一样,如果你安装的github的最新版maftools,请以maftools的官方文档操作为准。
- 参考GitHub issue:https://github.com/PoisonAlien/maftools/issues/409
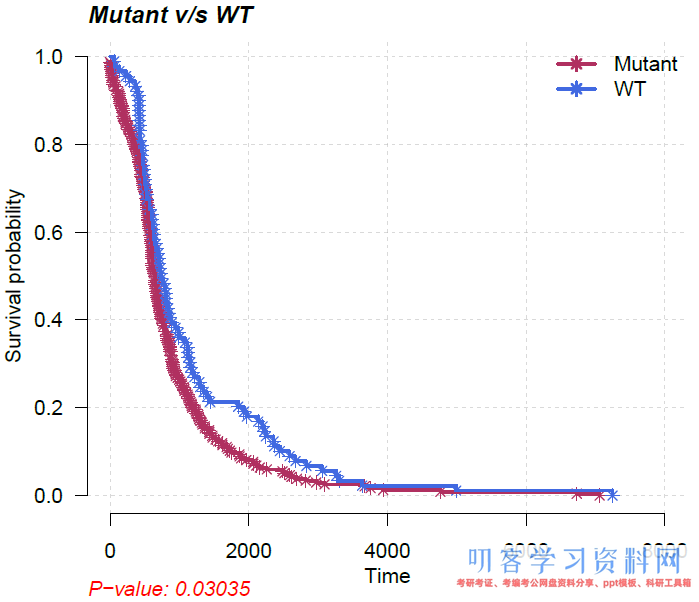
使用函数mafSurvival可以利用突变和临床数据绘制Kaplan-Meier曲线(KM曲线)进行生存分析。临床数据的处理请翻看上篇文章《肿瘤变异数据分析和可视化工具maftools:突变数据下载和可视化》。参数genes用于选定基因,time设定临床数据中保存随访时间的字段,Status设定临床数据中存放生存状态的。
参数isTCGA在这里设定数据是否来自TCGA。如果设定为TRUE,程序会将临床数据中\"Tumor_Sample_Barcode\"字段前12个字符截取出来和MAF文件进行匹配。因为我在上篇文章中通过一个Python脚本tcga_format.py已经做过这个处理了,所以这里是否设定TRUE都可以(未免麻烦,建议这么做)。
mafSurvival(maf=luad, genes=c(\"TP53\", \"TTN\", \"MUC16\"), time=\"days_to_last_follow_up\", Status=\"days_to_death\", isTCGA=TRUE)
输出突变/野生型样本数量、生存时间中位数等信息:
## Looking for clinical data in annoatation slot of MAF.. ## Number of mutated samples for given genes: ## TP53 TTN MUC16 ## 270 258 224 ## Median survival.. ## Group medianTime N ## 1: Mutant 606 414 ## 2: WT 704 153 ## Removed 178 samples with NA\'s
KM曲线和logrank test:
比较两个MAF文件(队列)
函数mafCompare通过对两个队列的MAF文件中所有基因进行Fisher精确检验检测差异突变基因。Maftools官方文档给了一个例子是Acute
Promyelocytic Leukemia(APL,急性早幼粒细胞白血病)在不同分期两个队列中的差异突变基因。2016年发表在Cancer
Cell上的一篇文章中分析了癌症中的性别差异。其中LUAD也是性别偏好性明显的癌症类别。这里我拿不同性别的TCGA-LUAD进行比较分析:
# 从临床数据中提取性别对应的\"Tumor_Sample_Barcode\" clin <- read.table(\"clinical.tsv\", header=T, sep=\"\\t\") clin.female <- subset(clin, gender==\"female\")$Tumor_Sample_Barcode clin.male <- subset(clin, gender==\"male\")$Tumor_Sample_Barcode # 使用subsetMaf构建男性和女性的MAF对象 luad.female <- subsetMaf(maf=luad, tsb=clin.female, isTCGA=TRUE) # 使用mafCompare比较差异突变基因 fvsm <- mafCompare(m1=luad.female, m2=luad.male, m1Name=\"Female\", m2Name=\"Male\", minMut=5) # 结果保存到文件\"female_vs_male.tsv\" write.table(fvsm$results, file=\"female_vs_male.tsv\", quote=FALSE, row.names=FALSE, sep=\"\\t\")
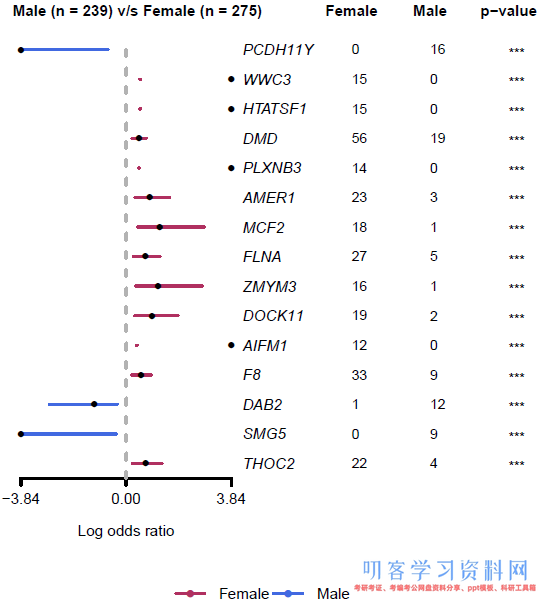
1. 绘制森林图
续上一个例子,用forestPlot可以绘制森林图展示分析结果:
forestPlot(mafCompareRes=fvsm, pVal=0.001, color=c(\"maroon\", \"royalblue\"), geneFontSize=0.8)
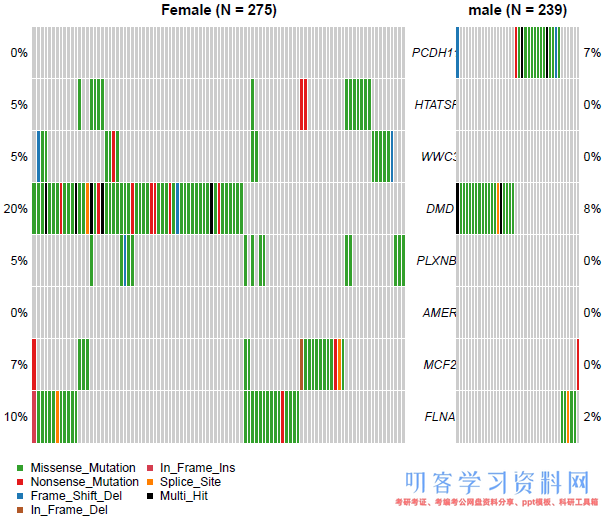
2. 比较两个队列的oncoplot
使用coOncoplot并排绘制两个队列的oncoplot:
genes <- c(\"PCDH11Y\", \"HTATSF1\", \"WWC3\", \"DMD\", \"PLXNB3\", \"AMER\", \"MCF2\", \"FLNA\") coOncoplot(m1=luad.female, m2=luad.male, m1Name=\"Female\", m2Name=\"male\", genes=genes)
3. 比较两个队列的棒棒糖图
使用lollipopPlot2比较两个队列突变位点和类型:
lollipopPlot2(m1=luad.female, m2=luad.male, m1_name=\"Female\", m2_name=\"Male\", gene=\"IQGAP2\", AACol1 = \"HGVSp_Short\", AACol2 = \"HGVSp_Short\")

临床富集分析
clinicalEnrichment可用于做临床数据的富集分析(突变富集在哪些临床特征上),和上面例子类似,这里对性别进行富集:
clin_enrich <- clinicalEnrichment(maf=luad, clinicalFeature=\"gender\")
clinicalEnrichment会进行两两配对(比如female vs male)和分组的Fisher精确检验(female vs rest),结果分别储存于$pairwise_comparision和$groupwise_comparision之中。这里就不贴返回结果了,用writetable保存到文件:
write.table(clin_enrich$pairwise_comparision, file=\"clin_enrich_pair.tsv\", quote=FALSE, row.names=FALSE, sep=\"t\") write.table(clin_enrich$groupwise_comparision, file=\"clin_enrich_group.tsv\", quote=FALSE, row.names=FALSE, sep=\"t\")
绘制富集结果,pVal用来控制输出pvalue的阈值,似乎目前还不能按照fdr进行筛选:
plotEnrichmentResults(enrich_res=clin_enrich, pVal=0.001)
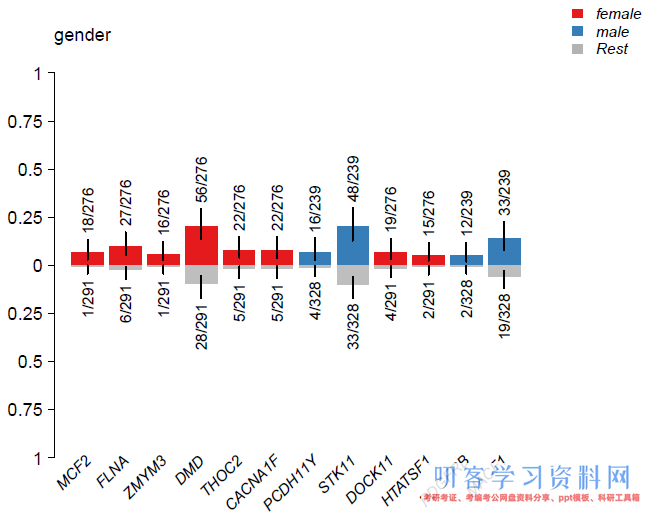
这里的分析做得比较粗糙,因为没有去掉未报道性别的case,建议先对临床特征进行筛选再使用,否则会影响groupwise的结果。
药物基因互作
drugInteractions函数可以通过查询编译到maftools中的Drug Gene Interaction database分析基因的成药性(gene druggability)以及药物和基因间的互作。注意:本函数用到的数据来源为纯科研用途,不构成医疗建议。
1. 基因的成药性
druggability <- drugInteractions(maf=luad) # 保存到文件 write.table(druggability, file=\"druggability.tsv\", quote=FALSE, row.names=FALSE, sep=\"\\t\")

图中展示潜在的可成药基因分类,每个分类后面中括号里的是前5的基因,少于5个就全部显示。Y轴为可成药基因分类中的基因数量。
2. 药物和基因间互作
通过给定基因或基因列表,查询相应互作的药物:
kras <- drugInteractions(genes=\"KRAS\", drugs=TRUE) # 展示其中部分列 kras[,.(Gene, interaction_types, drug_name, drug_claim_name)] # 保存到文件 write.table(kras, file=\"kras_drug.tsv\", quote=FALSE, row.names=FALSE, sep=\"\\t\")
输出结果:
## Gene interaction_types drug_name drug_claim_name ## 1: KRAS LENALIDOMIDE lenalidomide ## 2: KRAS IMGATUZUMAB GA201 ## 3: KRAS 3144 ## 4: KRAS SELUMETINIB Selumetinib ## 5: KRAS BUPARLISIB BKM120 ## --- ## 291: KRAS GEDATOLISIB Gedatolisib ## 292: KRAS XMT-1536 ## 293: KRAS GEMCITABINE Gemcitabine ## 294: KRAS NAVITOCLAX ABT-263 ## 295: KRAS PA-799 CH5132799
致癌信号通路
OncogenicPathways函数可以分析TCGA中已知的10个致癌信号通路中基因突变的数量和比例。包括cell
cycle, Hippo, Myc, Notch, Nrf2, PI-3-Kinase/Akt, RTK-RAS, TGFβ
signaling, p53 and β-catenin/Wnt:
OncogenicPathways(maf=luad)
输出致癌信号通路基因突变统计:
## Pathway alteration fractions ## Pathway N n_affected_genes fraction_affected ## 1: RTK-RAS 85 81 0.9529412 ## 2: WNT 68 64 0.9411765 ## 3: NOTCH 71 61 0.8591549 ## 4: Hippo 38 36 0.9473684 ## 5: PI3K 29 28 0.9655172 ## 6: Cell_Cycle 15 12 0.8000000 ## 7: MYC 13 11 0.8461538 ## 8: TGF-Beta 7 7 1.0000000 ## 9: TP53 6 6 1.0000000 ## 10: NRF2 3 3 1.0000000
绘制的散点图:
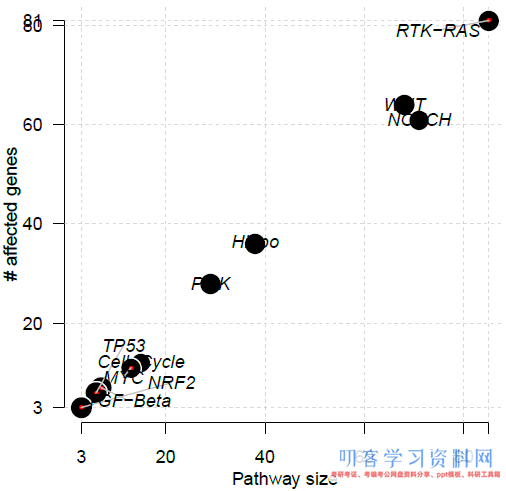
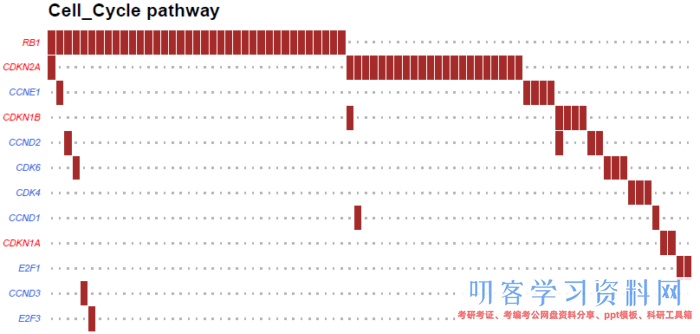
PlotOncogenicPathways函数也可以用瀑布图的形式展示某个pathway所有基因的图片情况,其中红色标注的基因为抑癌基因,蓝色标注的为致癌基因:
肿瘤异质性和MATH score
1. 肿瘤样品的异质性
肿瘤通常是异质性的,包含多种克隆。通过对等位基因频率VAF的聚类可以推断肿瘤的异质性。函数inferHeterogeneity可以实现这个功能(需要调用mclust):
# 指定Tumor_Sample_Barcodes为\"TCGA-55-7283\" vafclust <- inferHeterogeneity(maf=luad, tsb=\"TCGA-55-7283\") # 保存结果到文件 write.table(vafclust$clusterData, file=\"vaf_clustdata.tsv\", quote=FALSE, row.names=FALSE, sep=\"t\") write.table(vafclust$clusterMeans, file=\"vaf_clustmean.tsv\", quote=FALSE, row.names=FALSE, sep=\"t\")
输出结果中各突变基因VAF的数据储存在$clusterData中,聚类数量和平均VAF储存在$clusterMeans中。用plotClusters函数展示聚类结果:
plotClusters(clusters=vafclust)
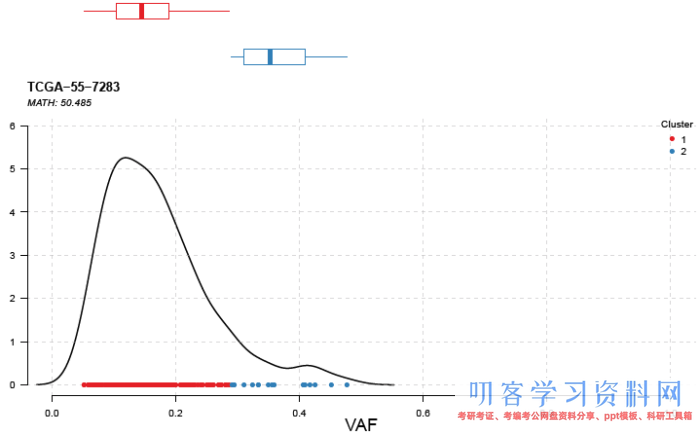
可以看到聚成两类,说明可能存在两种克隆。图上方的箱线图展示聚类中的数据分布。除了聚类的方法,还有一种用来量化肿瘤异质性的方式叫做\"MATH score\",用来计算VAF分布的宽度(即离散程度)。通常很高的MATH score与更差的预后相关。
2. 排除发生了拷贝数变异的突变基因
因为突变基因的CNV会影响到VAF的计算,因此在做聚类之前最好最好排除这部分基因。我们需要在TCGA上下载样品对应的DNACopy生成的Copy Number Segment文件。并把\"GDC_Aliquot\"字段替换为\"Sample\",该列内容也替换为对应的Tumor_Sample_Barcodes。这里以TCGA-38-4625为例:
<span class="token function">sed</span> \'s/GDC_Aliquot/Sample/g\' LOOBY_p_TCGAb58_SNP_N_GenomeWideSNP_6_E04_680252.nocnv_grch38.seg.v2.txt | <span class="token function">sed</span> \'s/d0597d14-df0c-413b-888f-53597d1fb61a/TCGA-38-4625/g\' > TCGA-38-4625.seg
重新运行inferHeterogeneity和plotClusters
vafclust <- inferHeterogeneity(maf=luad, tsb=\"TCGA-38-4625\", segFile=\"TCGA-38-4625.seg\") plotClusters(clusters=vafclust, genes=\'CN_altered\', showCNvars=TRUE)
inferHeterogeneity将根据读入的Segment文件去掉没有CNV数据的突变并标记存在CNV的突变。
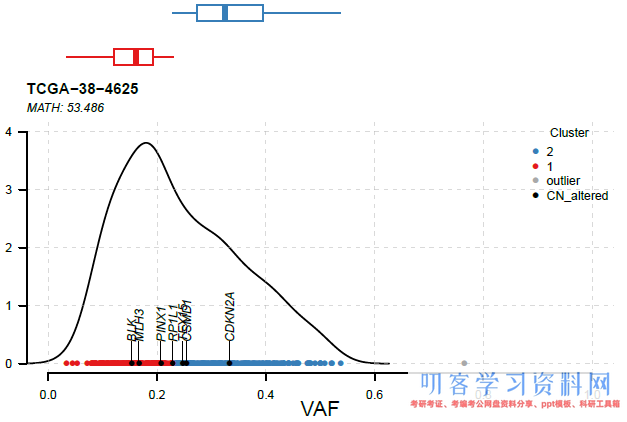
突变特征
1. 构建突变矩阵 & 计算APOBEC enrichment score
分析突变特征需要读入突变位点上下游的序列构建突变矩阵,因此需要使用到全基因组序列。这里因为作为案例的TCGA-LUAD使用的参考基因组是hg38,因此使用\"BSgenome.Hsapiens.UCSC.hg38\",如果参考基因组为hg19,则用对应的\"BSgenome.Hsapiens.UCSC.hg19\":
BiocManager::install(\"BSgenome.Hsapiens.UCSC.hg38\")
library(BSgenome.Hsapiens.UCSC.hg38, quietly=TRUE) # 预测APOBEC enrichment scores & 构建用于突变特征分析的突变矩阵 luad.tnm <- trinucleotideMatrix(maf=luad, ref_genome=\"BSgenome.Hsapiens.UCSC.hg38\")
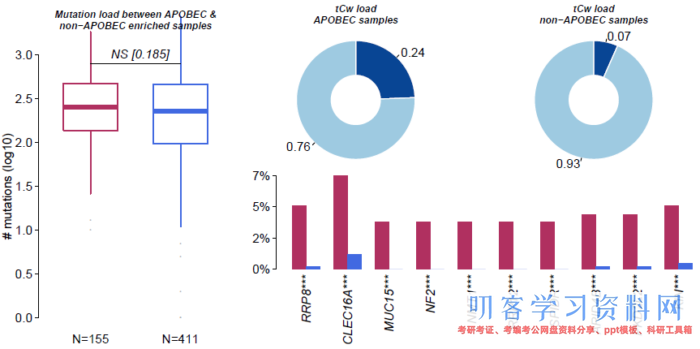
2. APOBEC富集和非富集样品差异
apobec_enrich <- plotApobecDiff(tnm=luad.tnm, maf=luad)
# 保存到文件
write.table(apobec_enrich$results, file=\"apobec_result.tsv\", quote=FALSE, row.names=FALSE, sep=\"t\")
write.table(apobec_enrich$SampleSummary, file=\"apobec_sum.tsv\", quote=FALSE, row.names=FALSE, sep=\"t\")
3. 突变特征分析
extractSignatures函数用于从96种替换类型中提取突变特征。这里nTry=6设定尝试n的最大值,程序将调用NMF计算cophenetic correlation coefficient并选取最合适的值。因为内存消耗太大,后面的例子都没跑通,有时间再补上:
library(\"NMF\")
luad.sign <- extractSignatures(mat=luad.tnm, nTry=6, plotBestFitRes=FALSE)
plotSignatures(luad.sign)
绘制成热图:
library(\'pheatmap\') pheatmap::pheatmap(mat=luad.sign$coSineSimMat, cluster_rows=FALSE, main=\"cosine similarity against validated signatures\")
4. 突变特征富集分析
luad.se <- signatureEnrichment(maf=luad, sig_res=luad.sign)
plotEnrichmentResults(enrich_res=luad.se, pVal=0.05)
参考资料
https://www.bioconductor.org/packages/release/bioc/vignettes/maftools/inst/doc/maftools.html
- 本文固定链接: https://maimengkong.com/zu/1403.html
- 转载请注明: : 萌小白 2023年3月12日 于 卖萌控的博客 发表
- 百度已收录
