作者:大水 来源:不孕拾遗
引 言
乙未年间,海外蛮夷美利坚领袖名巴马者始建言曰精准医疗,既而NGS测序风起云涌。相传东海之滨五角场坊间隐士拟有武功秘籍,上书:欲练神功,必先转发,认真钻研,神功可成。
——基因检测解读秘籍节选
基因检测解读秘籍系列
7
为什么有时要验证患者的父母?
8
为啥报告一定要写清楚转录本?
9
变异的人群频率有什么用?
10
致病等级是拿什么标准评的?
11
如何看待“临床意义未明”?
12
看了这么多报告,你关注过数据质量吗?
秘籍7、为什么有时要验证患者的父母?
对患者的变异进行致病性评估,目前是依据美国医学遗传学与基因组学学会(ACMG)在2015年发布的序列变异解释标准指南,简称ACMG指南[1]。

在ACMG指南中,明确提到有需要验证父母的情况,这对变异的致病性评估是必要的[2]。
PS2 PM6 新发变异
关于新发变异,我们在第3期有过详细的解释。每个人都携带了极少量新发变异,它们并不一定有害。但如果如此少量的新发变异与患者临床表型相关,我们就需要考虑它是患者的致病原因了。
一个与表型相关的新发变异,可被归为PS2(强证据)或PM6(中等证据),差别就在于父母样本的验证。
PS2:患者的新发变异,且无家族史(经双亲验证);
PM6:未经父母样本验证的新发变异。
因此,当怀疑患者检出的变异为新发变异时,对父母进行验证,可以对位点致病性得到更好的判断。
PM3 BP2 顺式/反式检测
顺式(cis)和反式(trans)在拉丁文中分别指“在……同一边”和“在……另一边”。
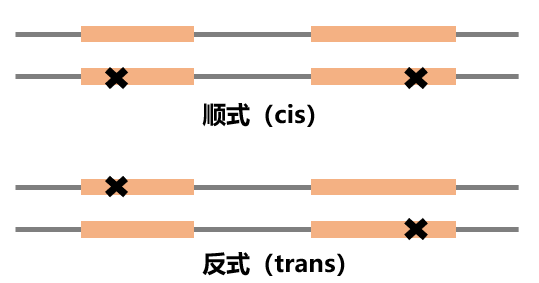
PM3:在隐性遗传病中,在反式位置上检测到致病变异。 注:这种情况必须通过患者父母或后代验证。
假如我们检出了两个杂合变异,其中一个为已知的致病变异,另一个变异待分类。
当两个杂合变异呈反式排列时,这可以作为待分类变异的中等致病证据(PM3)。[2]
BP2:在显性遗传病中又发现了另一条染色体上同一基因的一个已知致病变异,或者是任意遗传模式遗传病中又发现了同一条染色体上同一基因的一个已知致病变异。
以B开头的字母均为位点为良性(Benign)的证据,“BP”属于支持证据。它支持该位点不会导致疾病。
以上对于BP2的描述可以用下图表示:
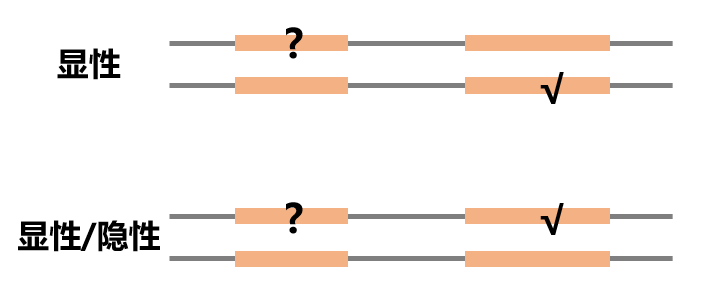
打问号的是待分类位点,打对勾的是已知致病位点。以上两种情况均可被分类为BP2。
以上对于顺式和反式的检测依赖于父母样本的验证,这对于给出相应的致病性证据是必要的。
变异位点的验证
ACMG指南的5.6部分强调了变异的验证[2]。
对于孟德尔疾病的致病或可能致病变异需进行正交法验证。具体方法包括但不限于以下几种: 重新取样和检测、检测父母的变异情况、限制性内切酶消化、对于目标区域重新测序或使用另一种基因分型技术。
目前,进行二代测序的检验机构一般都会使用Sanger测序再次对位点进行核实,以保证位点的准确性。对该位点进行双亲验证,同样有验证位点准确性的作用。
需要注意的问题
需确认生物学家庭关系,排除收养、非生父、精子和卵子捐献以及其他非生物学关系。
如果测序方案选择了trios-WES(一家三口都做全外测序),那么可以选择根据测序数据来判断亲缘关系(使用IBD矩阵,SNP分布等计算方法),但检测机构是不能出具亲缘关系鉴定报告的,仅作为数据的质量控制。
但是,如果使用Sanger测序,在父母样本中验证患者变异位点时,送检方无法通过数据得知患者和父母的真实生物学关系。在验证与预期不符,寻找出错可能性时,送检方需要能想得到排除这一点。
存在生殖细胞嵌合现象时,可能有1个以上患者的同胞患病。
这一点在第3期中也有所提及。对新生儿进行遗传咨询时,要注意区别新发变异和低比例生殖腺嵌合的情况。
总结
对于显性基因的新发变异,以及隐性基因的复合杂合变异,均需要使用父母样本进行验证,这对于位点致病性的评估至关重要。在这一点上,负责遗传咨询的医生需说服患者及其父母予以配合,完成整个遗传咨询的流程。
秘籍8、为啥报告一定要写清楚转录本?
什么是转录本?
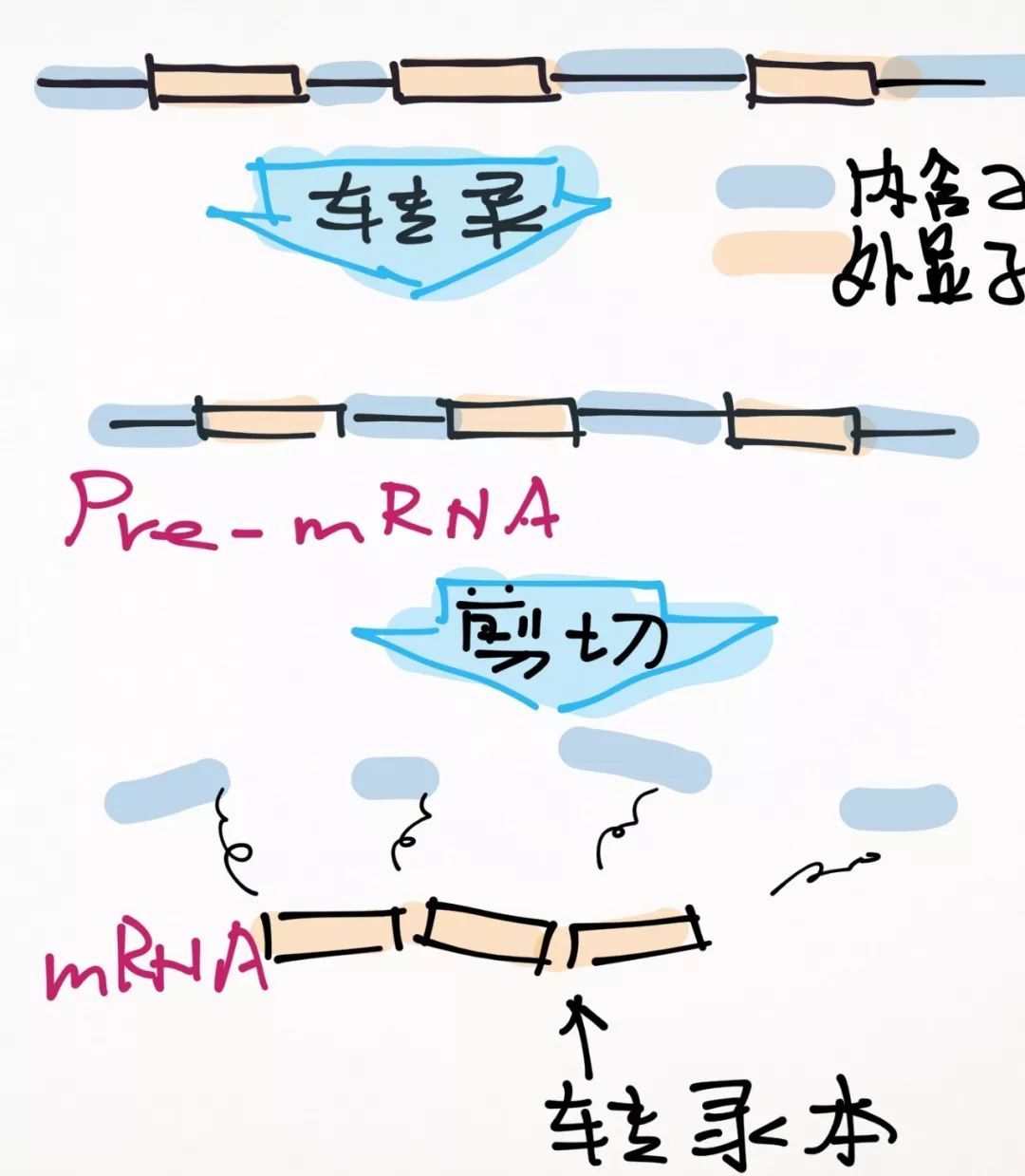
一个基因想要行使功能,需要先经过转录,变成mRNA飘出细胞核去,和核糖体一起翻译蛋白。转录时,先形成了mRNA的前体Pre-mRNA,经过剪切后才形成了成熟的mRNA。剪切有时候有很多种剪法,不同剪法对应不同的转录本。
对于检测报告中如何体现转录本,让我们看看ACMG指南中怎么说的吧。
当描述编码变异时,应该在报告中使用和提供每个基因的一个参考转录本。该转录本应该是最长的已知转录本或者是最具临床相关性的转录本[1]。
首先,在绝大多数时候,遗传检测报告中都使用了已知最长的那个转录本。这是最保险的做法,不太会出现某个外显子上的变异注释到其它转录本的内含子上,从而被认为对蛋白没有作用。
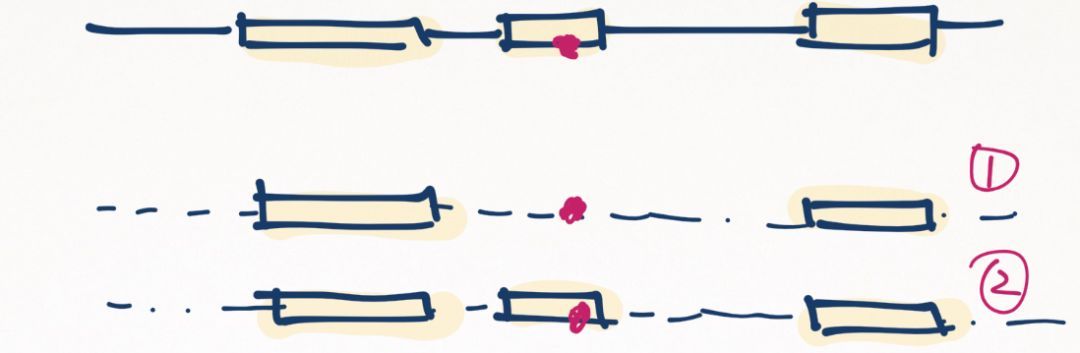
然而,有些特殊情况需要注意。有的时候最长的那条转录本,可能不是“最具临床相关性”的那个。
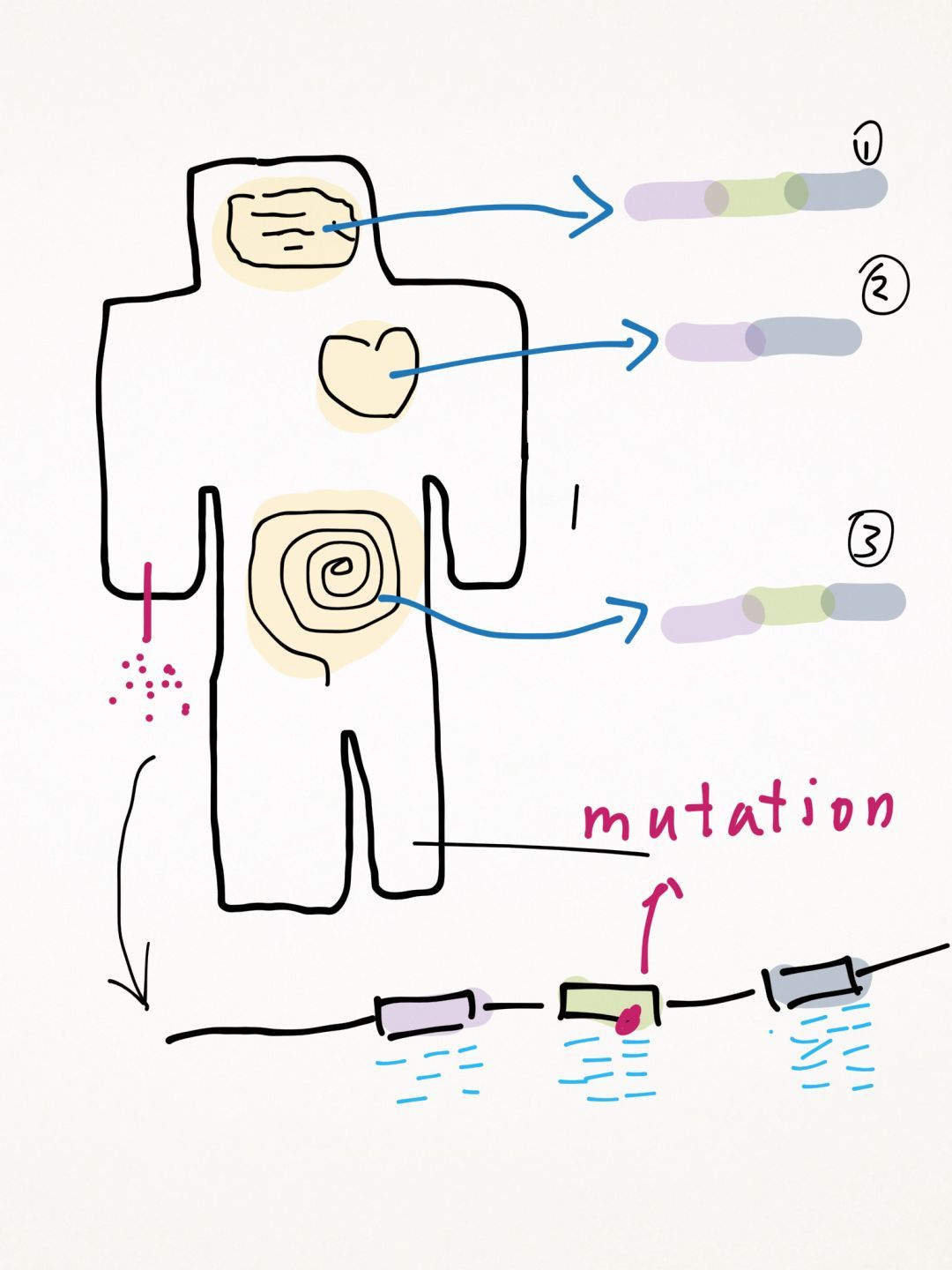
假如某个基因的有红、绿、蓝三个外显子,它可能有三种选择性剪切的形式,分别在大脑、心脏和肠道特异性表达。在进行基因检测时,由于是对DNA进行测序,不管样本取哪里都可以测到所有外显子,而不需要考虑哪个组织表达哪些转录本的问题(RNA测序或许会考虑)。如果受检患者的表型是心脏上的毛病,那么在解释变异时,就要怀疑这个变异的致病性了,因为这个变异在心脏中根本不体现功能。
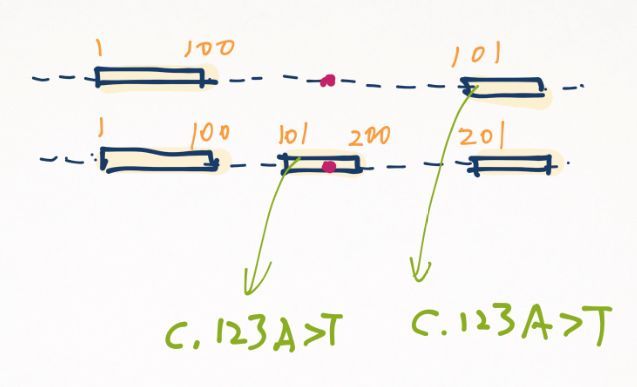
还有一点需要提到,在将一些特殊病例整理成文章的时候,也要注意标明转录本。有很多文章不注意这一点,这会造成别人引用时心里没底:虽然默认是报最长的那个,万一他报了个别的呢?因为“c.123A>T”这样的描述,很可能在某个基因中不是唯一的。
秘籍9、变异的人群频率有什么用?
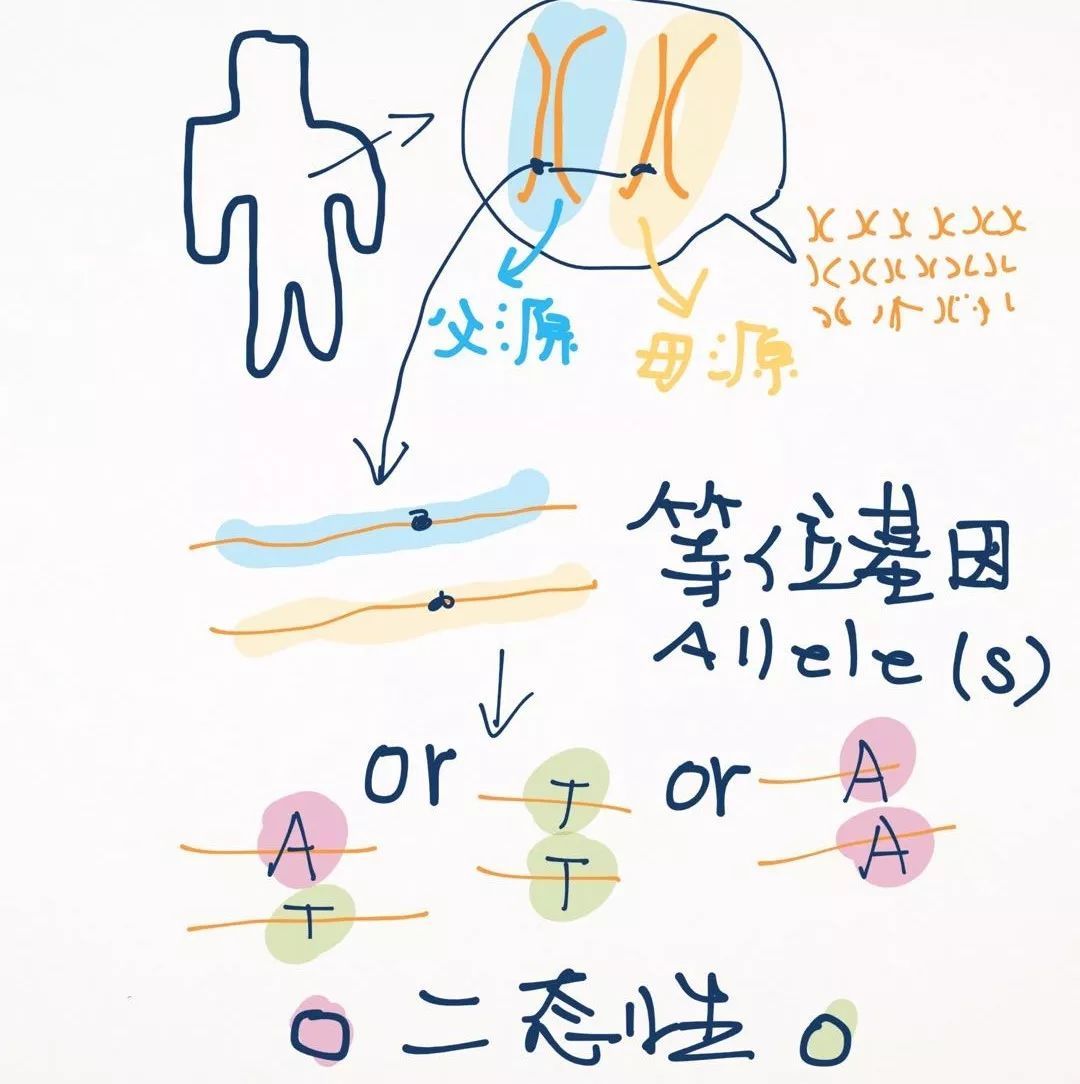
首先来介绍一下位点的人群频率。这个人群频率是一个通俗称呼,应该叫做“等位基因频率”(Allele Frequency,AF)。
人之所以有“等位基因”的概念,是因为人是二倍体生物,有两套基因组,一套父源、一套母源。因此,基因组中的每个基因都有两份拷贝。
基因中的绝大多数变异都是二态性的。我们认为基因组足够广阔,而变异则没有那么多,不太可能在同一个位置发生两次变异(例如野生型是A,突变为T,又从T突变到G)。
那么什么是等位基因的频率呢?我们知道每个人都有两份拷贝。如果有n个人,则有2n份拷贝,等位基因频率是在这2n个拷贝中计算频率。
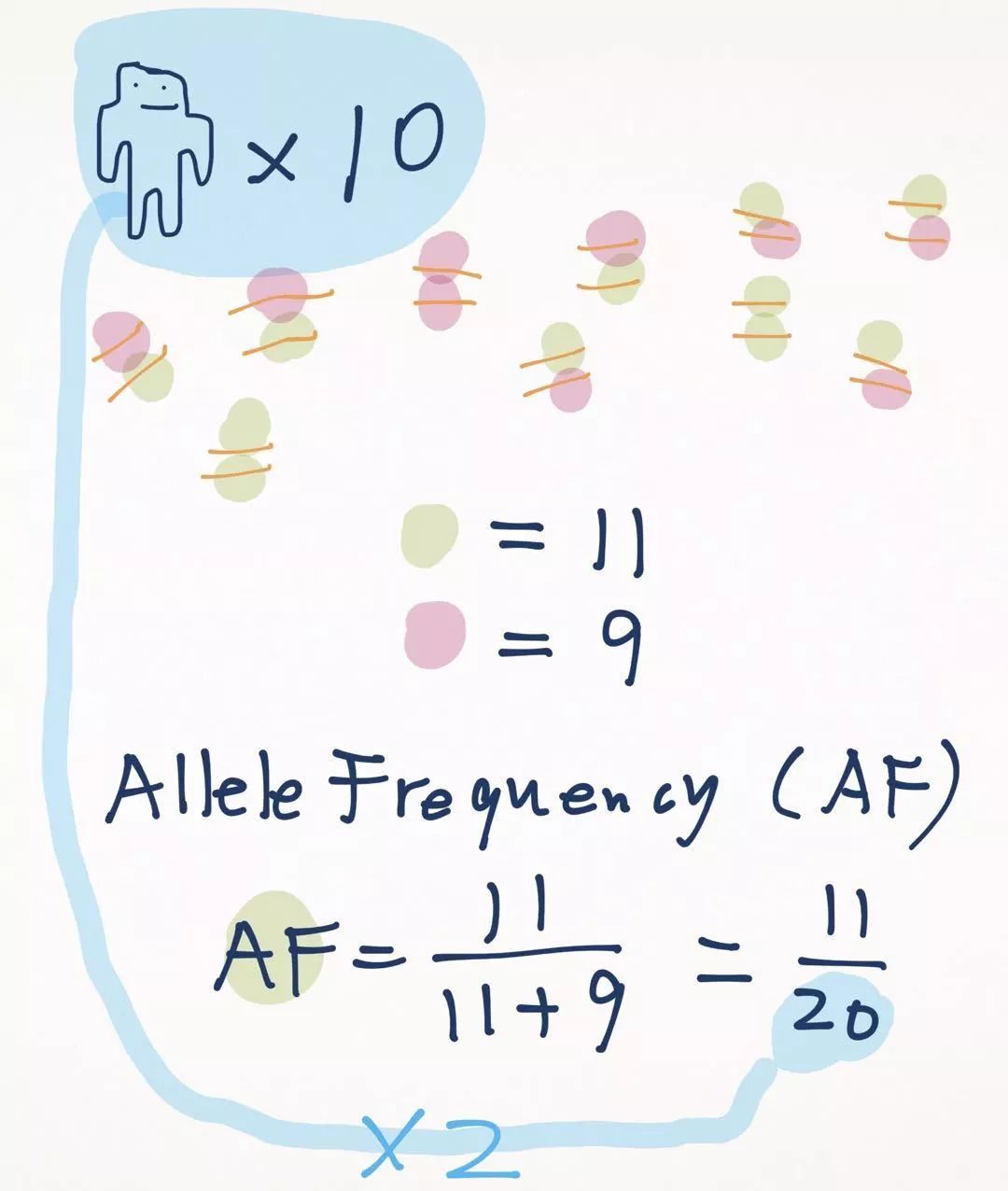
知道每个变异位点的等位基因频率,对于我们判断该变异的致病性至关重要。位点致病性越强,等位基因频率越低,位点越罕见。变异若致病,严重到影响人的生存,也就失去了传代的机会,因此人群中极罕见。
回到计算人群频率的问题上来。我们知道了变异大多是二态性,例如A和T,那么计算AF时,到底是A做分子还是T做分子呢?所谓等位基因频率,是哪个等位基因的频率?
人们做了一个规定,这个AF是变异位点的AF。变异位点定义为和参考基因组不一样的那个位点。
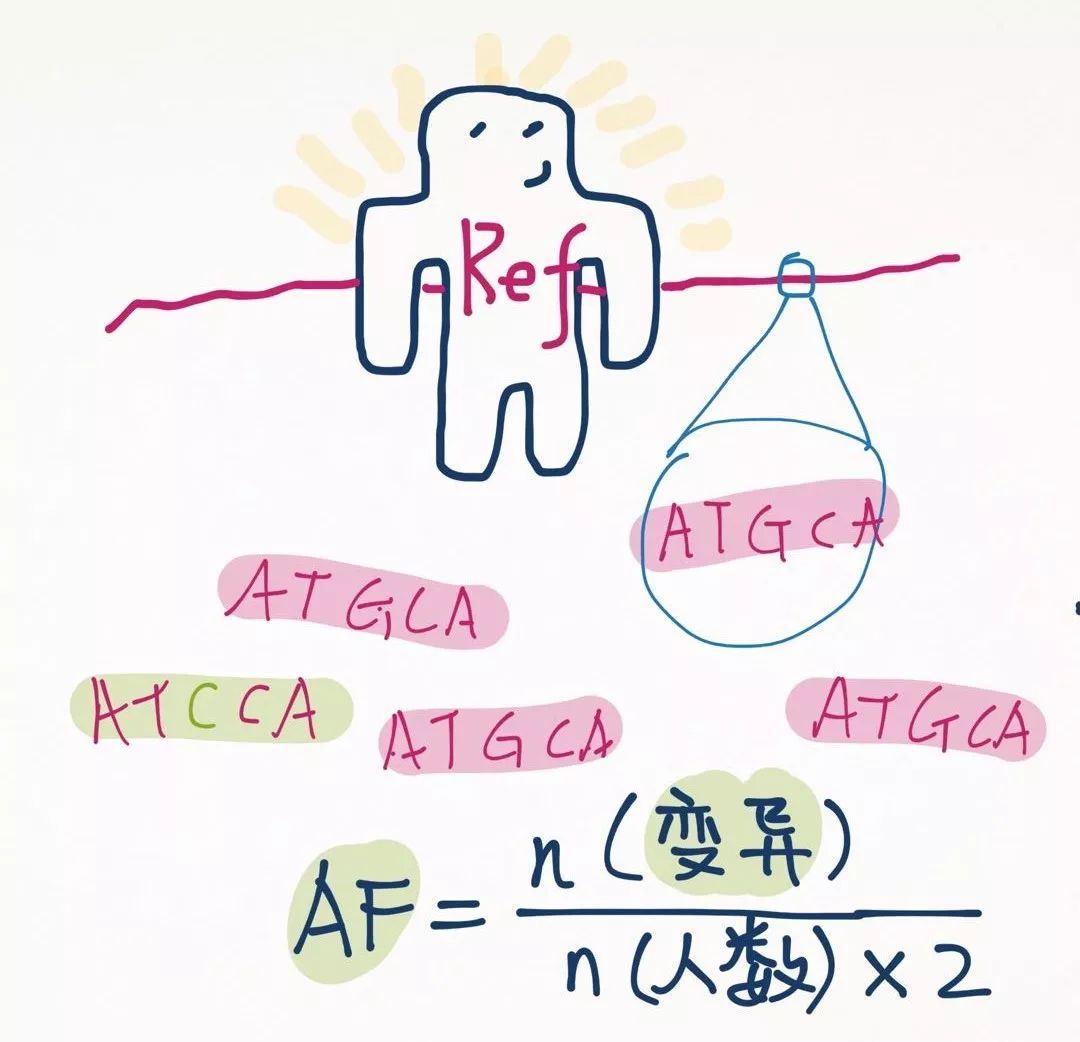
注意,n(变异)不是指携带变异的个体数,而是等位基因数哦~携带纯合变异的个体算做2个变异。
看一下指南中和人群频率相关的条目[1]。
PS4:变异出现在患病群体中的频率显著高于对照群体;
PM2:ESP数据库、千人数据库、EXAC数据库中正常对照人群中未发现的变异(或隐性遗传病中极低频位点);
BA1:ESP数据库、千人数据库、ExAC数据库中等位基因频率>5%的变异
BS1:等位基因频率大于疾病发病率
BS2:对于早期完全外显的疾病,在健康成年人中发现该变异(隐性遗传病发现纯合、显性遗传病发现杂合,或者X连锁半合子)
PS4不会用到人群数据库,它依赖GWAS的统计数据,我们先放一边。其它条目在具体使用时,还需要注意很多细节,例如需要参考不同来源的人群,等位基因在该群体中的数量是否足够,该位点的测序覆盖深度是否足够等。我们在本文中不展开讨论。
如何得知某一个位点的人群频率?可以根据位点坐标,去1000G Genomes,ESP,ExAC和gnomAD等公共数据库检索,也可以使用注释软件如VEP、ANNOVAR等批量注释获得。- 本文固定链接: https://maimengkong.com/zu/1404.html
- 转载请注明: : 萌小白 2023年3月19日 于 卖萌控的博客 发表
- 百度已收录
