文章信息
文章:An atlas of the aging lung mapped by single cell transcriptomics and deep tissue proteomics
期刊:Nature Communications

组学技术:scRNA-seq、mass spectrometry-based proteomics、bulk RNA-seq
材料:scRNA-seq:3月龄小鼠(n=8)和24月龄小鼠(n=7);
mass spectrometry-based proteomics:3月龄小鼠(n=4)和24月龄小鼠(n=4);
bulk RNAseq:3月龄小鼠(n=3)和22月龄小鼠(n=3)
研究背景
衰老会导致肺功能下降,也是全球第三大死亡原因——慢性肺病发展的主要危险因素。本文作者使用单细胞转录组学和基于蛋白质组学的质谱分析(mass spectrometry-based proteomics)来量化年轻和年老小鼠肺部30种细胞类型的细胞活性状态变化。作者发现,衰老会导致转录噪声增加,并且放松对表观遗传的控制。作者还观察了衰老对于细胞类型特异性的影响,发现2型肺细胞和脂肪成纤维细胞胆固醇合成的增加,以及呼吸道上皮细胞的改变,是肺部老化的几大标志。本文通过蛋白组与单细胞转录组的整合分析预测了调节性蛋白的细胞来源,构建了一个无偏倚的肺衰老图谱。
研究结果
1、肺衰老图谱揭示转录调控的下调
作者取了15只小鼠一共捕获到14813个细胞(图1a,年轻小鼠8只,共7672个细胞;老年小鼠7只,共7141个细胞)。通过使用高变基因对所有细胞进行无监督聚类,最终分成36个细胞群分别对应30种细胞类型,包括所有已知的上皮细胞、间充质细胞和白细胞系(图1b,c)。
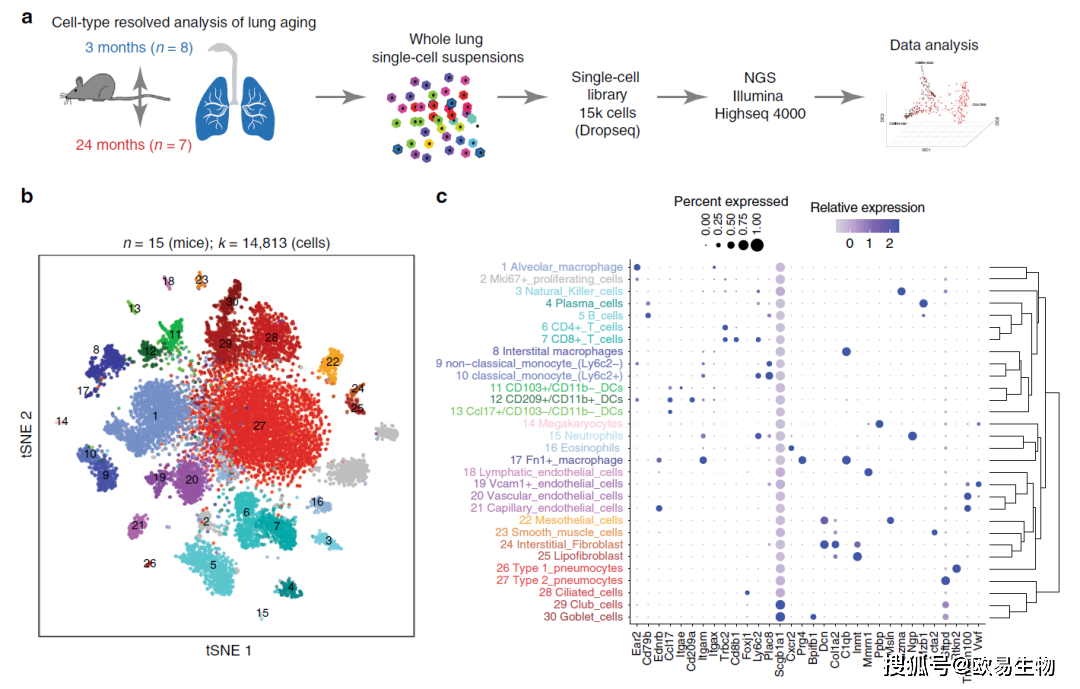
图1 | 单细胞图谱揭示小鼠肺部主要细胞类型
图1 | 单细胞图谱揭示小鼠肺部主要细胞类型
据报道,衰老是转录不稳定性增加的结果,而非转录协同产生的,并且与衰老相关的转录噪声增加可能会导致不明确的细胞类型出现。因此,作者对转录噪声做了量化分析,主要方法是计算每组年龄内每个细胞和细胞类型之间的欧式距离,该欧氏距离用作每个细胞转录噪声的一种度量。结果发现,随着年龄的增长,大多数细胞类型的转录噪声增加(图2a)。为了进一步排除技术混淆,作者将每只小鼠样本得到的欧氏距离取平均值,获得了高度一致的结果(图2b)。这项分析证实了转录噪声会随着年龄的增长而增加(图2c,d),这与之前关于人类胰腺或小鼠CD4+T细胞的报道一致。

图2 | 随着年龄增长大多数细胞类型的转录噪声增加
图2 | 随着年龄增长大多数细胞类型的转录噪声增加
2、mRNA和蛋白的数据整合
为了验证单细胞RNA测序(scRNA-seq)数据的完整性,以及肺部mRNA和蛋白含量随年龄的变化,作者又分别取了6个(每组3个重复)和8个(每组4个重复)年轻和年老小鼠进行bulk RNA测序和蛋白质组质谱分析(图3a)。作者利用scRNA-seq数据,将每个小鼠所有细胞的表达量求和模拟出一份bulk RNA数据,通过相关性分析观察到真实bulk RNA数据和模拟数据之间存在很好的一致性,从而排除了单细胞解离过程可能带来的干扰影响(图3b)。此外,作者还观察到三组数据集在年龄变化上的强烈相关性(图3c)。
无论在转录还是蛋白水平,上游调节基因表达量变化表现都非常相近(图3d)。在转录和蛋白两组数据中,作者发现了一个促炎症特征,包括Il6、Il1b、Tnf和Ifng上调,以及Pparg和Il10下调(图3d)。受年龄调节的大多数基因集在转录组和蛋白质组中都显示出相同的富集调控方向,且富集得分的pearson相关性系数显著(图3e)。许多细胞外基质基因,如Ⅲ型胶原,在mRNA和蛋白质水平均下调,所有基底膜相关的Ⅳ型胶原基因在蛋白水平均升高,但在转录水平(图3f)和RNA原位杂交(图3g)中的表达水平均降低。IV型胶原在转录和蛋白水平的差异突出了mRNA和蛋白结合分析的重要性。作者用免疫荧光法验证了IV型胶原蛋白丰度的增加,有趣的是,老年小鼠的IV型胶原主要在呼吸道和血管周围增加(图3g)。
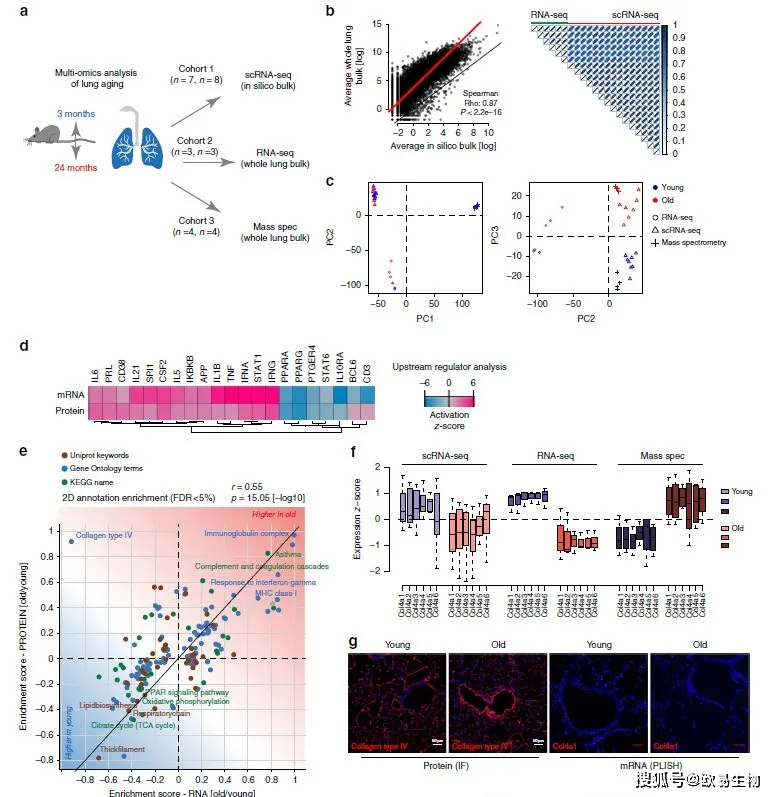
图3 | 多组学数据整合揭示了RNA和蛋白质的调控关系
图3 | 多组学数据整合揭示了RNA和蛋白质的调控关系
3、衰老会改变呼吸道上皮细胞和细胞外基质
作者分析了30种细胞类型组成随年龄的变化,利用多维标度法(isoMDS() R function)对各细胞类型计数进行降维后,发现第一维度和年龄存在显著关联(图4a,b;Wilcoxon检验,p<0.005),表明年轻和年老小鼠之间细胞类型组成不同。结果发现,与年轻小鼠相比,老年小鼠中纤毛细胞相对增多(图4c,d),老年小鼠的各种免疫细胞群也显著增加,包括CD4+和CD8+T细胞、嗜酸性粒细胞和经典单核细胞(图4e),且纤毛细胞的标记基因呈显著上调(图4f)。作者使用Foxj1(纤毛细胞标记物)和CC10(纤毛细胞标记物)进行免疫染色验证了这一发现(图4g)。在这项分析中,老年小鼠的纤毛细胞增多(图4h),导致了老年小鼠呼吸道中棒状细胞和纤毛细胞比例发生了显著改变(图4i)。

图4 | 细胞类型分析揭示老年小鼠呼吸道纤毛细胞的增加
图4 | 细胞类型分析揭示老年小鼠呼吸道纤毛细胞的增加
作者在5138个蛋白中鉴定得到32个在老化过程中有显著变化的基质蛋白(图5a)。发现在老年小鼠中胶原XIV下调(图5b),利用scRNA-seq数据将胶原XIV的表达定位到了间质成纤维细胞,这些成纤维细胞和间皮细胞也同时表达Decorin(图5c)。以上结果表明,蛋白质组学与单细胞转录组学的结合能够使我们预测调控蛋白的细胞来源。
作者应用先前开发的QDSP方法比较年轻和年老小鼠之间的蛋白质溶解度分布(图6a)。通过对432种分泌型胞外蛋白的主成分分析,发现蛋白溶解度在第1主成分中分离,而年龄在第4主成分中分离(图6b),分析还表明,许多ECM蛋白的丰度和溶解度,包括I型胶原和基底膜层粘连蛋白,均没有发生改变,但是与基底膜相关的Fras1、Frem1,Frem2等在老年小鼠中均有下调(图6c-i)。
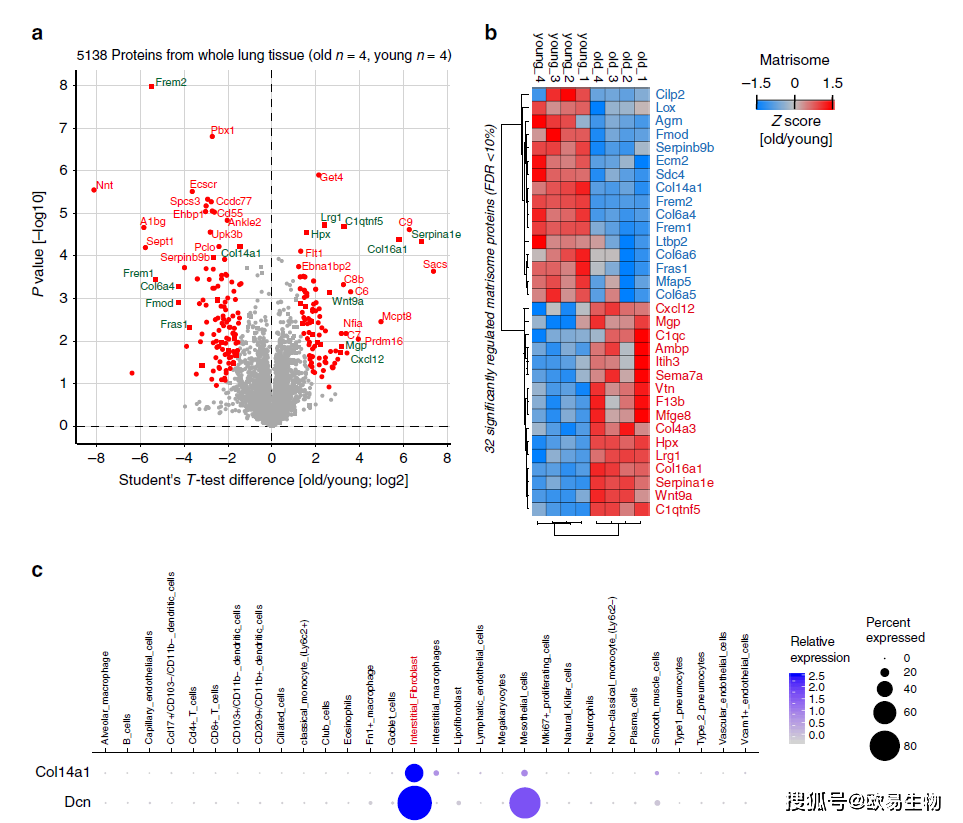
图5 | 通过单细胞转录组预测调控蛋白的细胞起源
图5 | 通过单细胞转录组预测调控蛋白的细胞起源
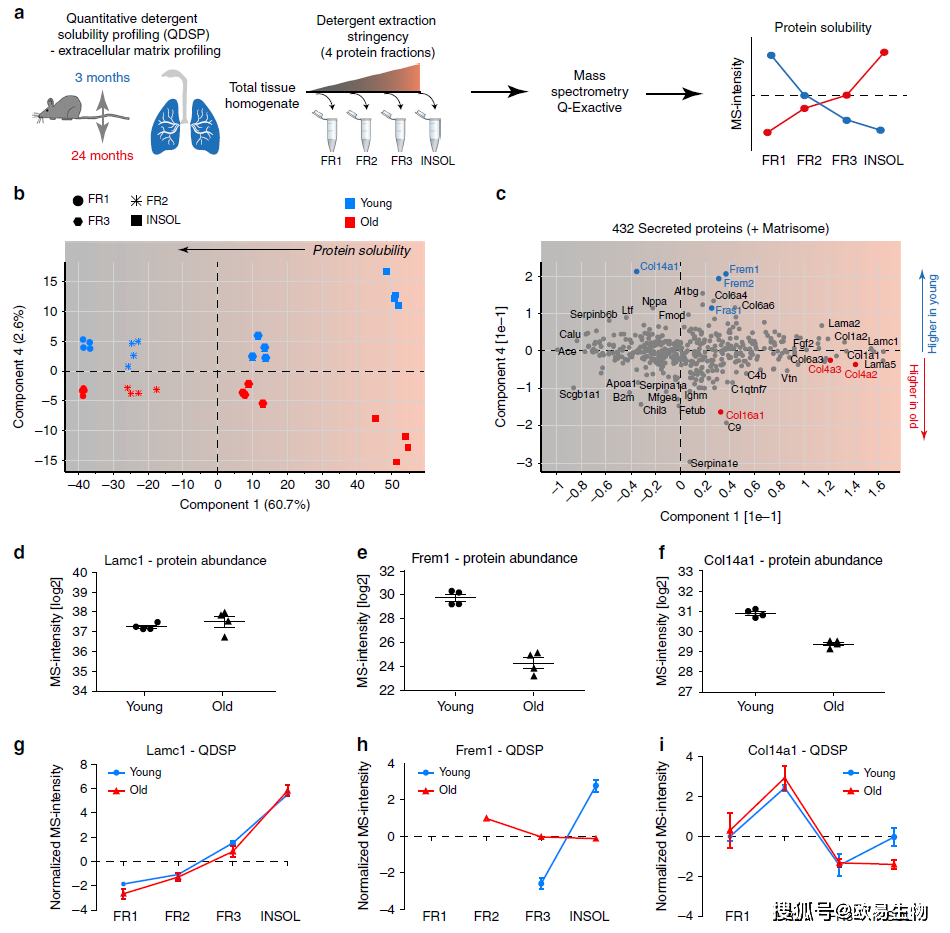
图6 | QDSP方法揭示细胞外基质(ECM)结构的变化
图6 | QDSP方法揭示细胞外基质(ECM)结构的变化
4、衰老对细胞类型的影响
通过对年轻和年老组间差异表达筛选出391个差异显著基因(Wilcoxon秩和检验,FDR<10%)(图7a),肺泡巨噬细胞和2型肺泡细胞是细胞数量最多的两种细胞类型,这两种细胞类型都在老年小鼠中表现出了明显变化(图7b-c)。作者观察到MHCⅠ类基因H2-K1、H2-Q7、H2-D1和B2m基因显著上调(图7c),并用流式进行了验证(图7k-l)。作者利用肺泡巨噬细胞和2型肺细胞的单细胞转录组数据进行了PCA主成分分析和细胞类型注释(图7d-e),发现流式分选后的bulk RNA-seq与scRNA-seq结果呈现高度一致(图7f-j)。
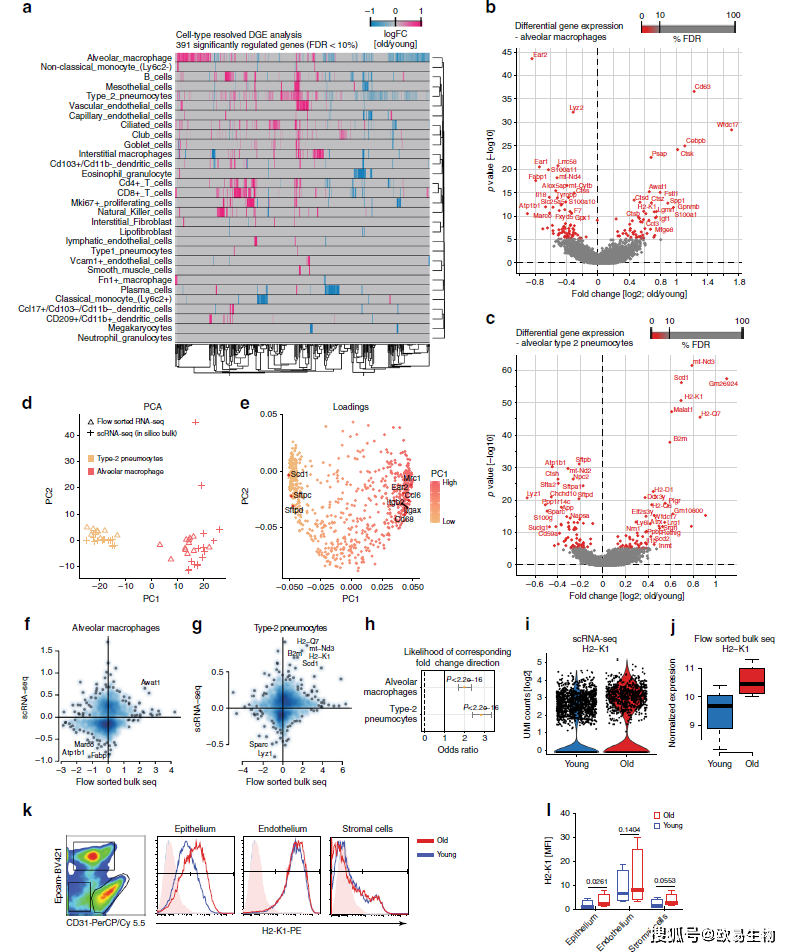
图7 | 单细胞转录组测序中细胞类型差异分析
图7 | 单细胞转录组测序中细胞类型差异分析
5、衰老细胞中胆固醇的合成增加
基于25个SREBP/Insig1已知靶点的上游调控网络分析发现,所有靶点均在衰老的2型肺泡壁细胞中增加(图8a)。通过Uniprot、GO、KEGG注释富集分析,作者发现胆固醇合成增加在2型肺泡壁细胞和脂肪成纤维细胞中非常显著,没有涉及到其他细胞类型(图8b),大多数Insig1/2靶基因直接参与胆固醇的生物合成过程(图8c)。为了确认胆固醇合成的增加并分析细胞的实际脂质含量,作者进行了免疫荧光检测发现老年肺部脂质体染色增加在肺泡2型细胞存在特异性(图8d)。此外,作者通过流式细胞术和尼罗红染色发现,老年小鼠CD45-细胞的平均荧光强度显著增加(图8e-g),CD45+细胞无明显改变,表明中性脂质含量增加是上皮细胞和成纤维细胞所特有。至此,作者已经证明2型肺泡壁细胞和脂肪成纤维细胞胆固醇合成和中性脂质含量的增加是肺衰老的标志。
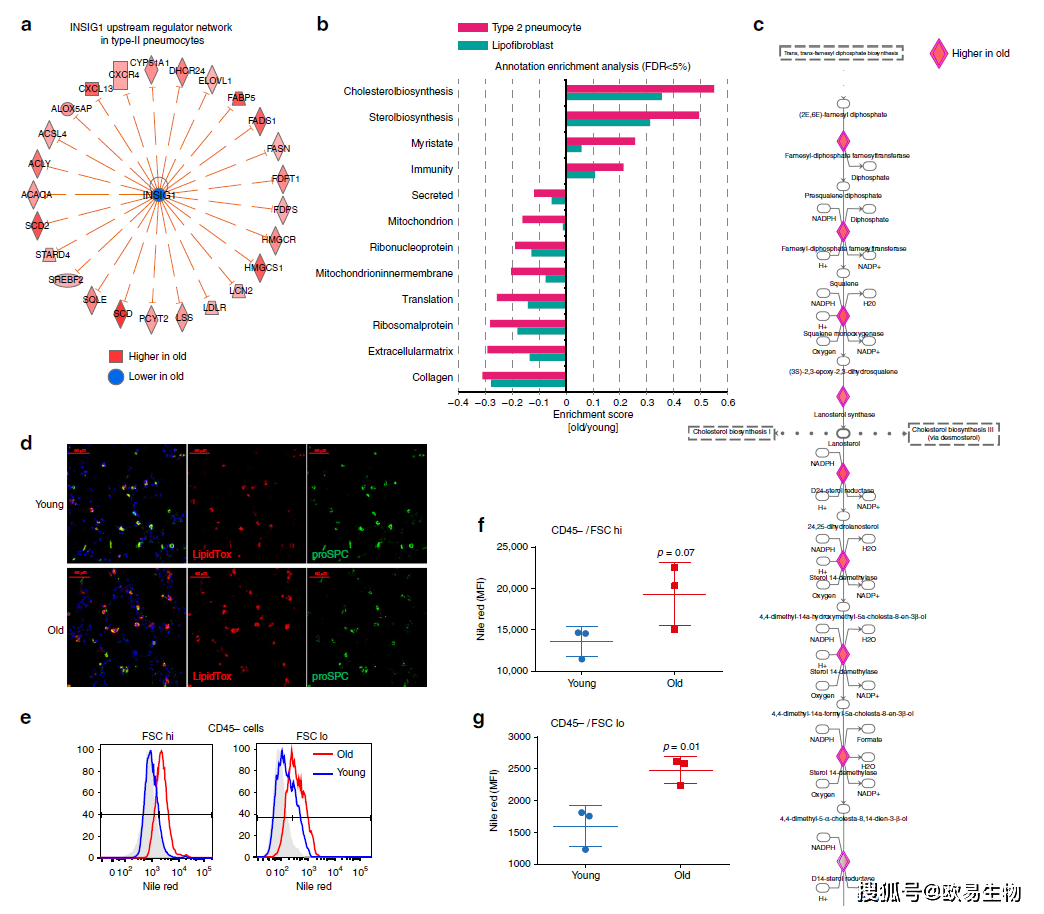
图8 | 衰老小鼠中2型肺泡壁细胞和脂肪成纤维细胞中的胆固醇合成增加
总结
作者使用单细胞转录组和蛋白质谱分析量化了30种细胞类型的细胞活性状态变化,通过整合分析,很好地预测了调节性蛋白的细胞来源,创建了肺衰老细胞参考图谱。
本文揭示了肺部老化的几大标志:2型肺泡壁细胞和脂肪成纤维细胞胆固醇合成的增加,以及呼吸道上皮细胞的改变。
参考文献
Angelidis I, Simon L M, Fernandez I E, et al. An atlas of the aging lung mapped by single cell transcriptomics and deep tissue proteomics[J]. Nature communications, 2019, 10(1): 1-17.
END
转载自欧易生物
- 本文固定链接: https://maimengkong.com/zu/758.html
- 转载请注明: : 萌小白 2021年8月25日 于 卖萌控的博客 发表
- 百度已收录
