期刊:Theranostics
技术:单细胞测序
研究背景
慢性牙周炎是由牙周组织的慢性炎症组成的常见疾病,它是一种在人类中非常普遍的疾病,影响全球约20%-50%的人口。慢性牙周炎可使个体易患全身性疾病,例如心血管疾病、糖尿病和阿尔茨海默病,以及胃肠道疾病和不良妊娠结局。牙周炎治疗的主要目标是控制消息和炎症,阻止牙周组织破新,防止牙槽骨丢失。在牙周炎进展过程中,大量免疫细胞通过产生影响骨细胞的细胞因子和生长因子来激活和调节免疫反应。免疫细胞包括巨噬细胞、调节性T细胞(Tregs)、TH17细胞、记忆B细胞和浆细胞已确定与牙周炎发病机制相关。如今,骨免疫学已将骨骼研究领域扩展到与骨质减少相关的慢性炎症性疾病的所有领域,例如类风湿性关节炎、炎症性肠病和牙周炎。单细胞RNA测序(scRNA-seq)能够以单细胞分辨率对细胞群进行特异性分析,这极大地改变了我们研究免疫微环境的能力。scRNA-seq将为了解失调的骨免疫相互作用和更具体地靶向参与病理性骨丢失的细胞铺平道路。在这项研究中,使用单细胞转录组学来全面解析牙周组织所涉及的骨免疫学微环境。在单细胞水平上对许多异质细胞进行评估,揭示了分子成分的复杂性以及与牙周组织中对应细胞的差异。
研究结果
1. 人牙周组织的scRNA-seq和细胞构成
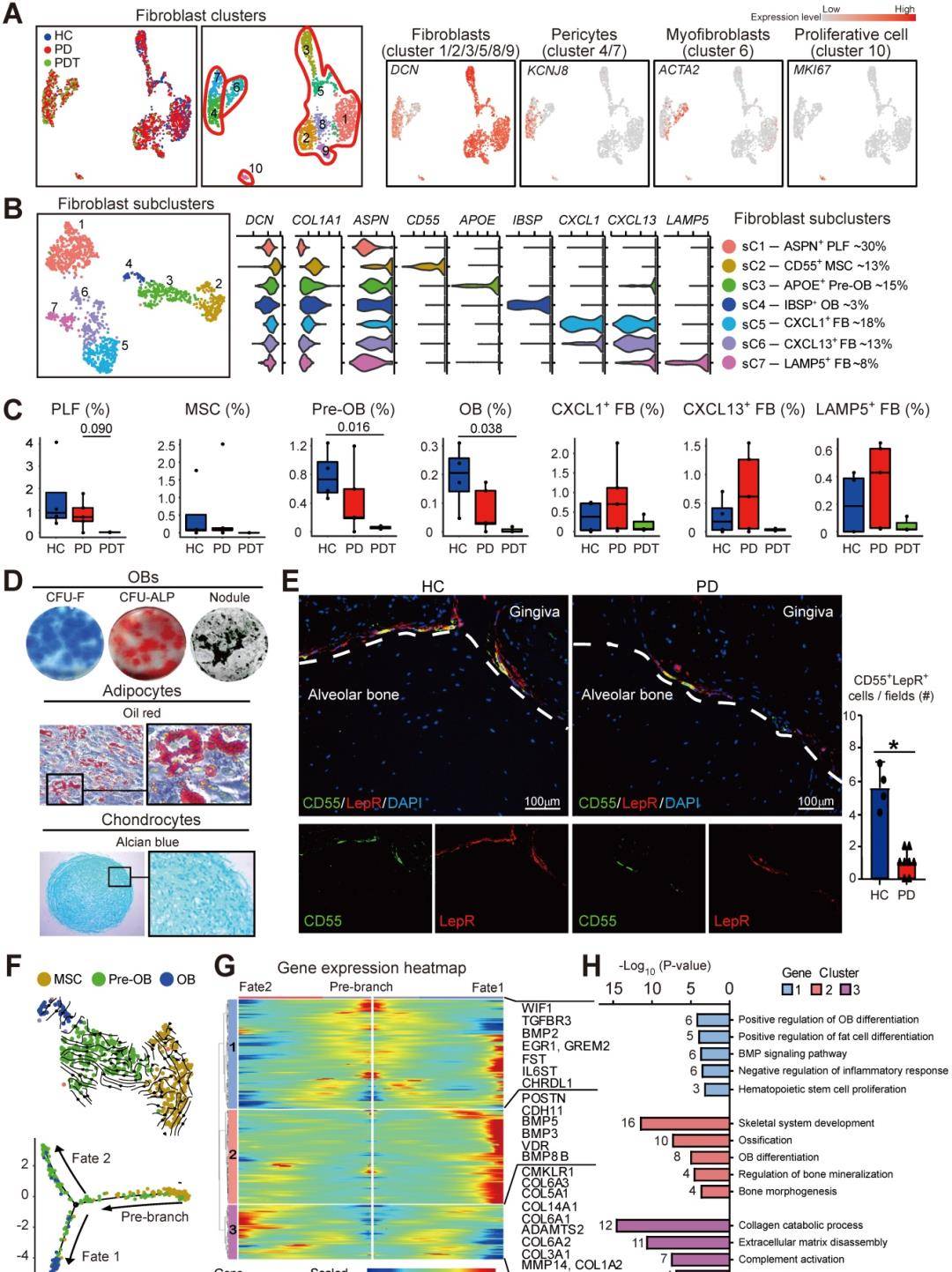
测试人类牙周组织中细胞群的构成,对四种健康对照(hcs),五名患有严重慢性牙周炎(pds)的患者和三名患有严重慢性牙周炎的患者进行了人体牙周炎分析(图1a)。通过UMAP分析进一步鉴定了成纤维细胞簇的细胞群。图1B中检测到的成纤维细胞呈异质性,分为四组,包括6个成纤维细胞簇(簇1/2/3/5/8/9)、2个周细胞簇(4/7簇)、1个肌成纤维细胞簇(簇6)和一组增殖细胞(簇10)(图2A)。具体而言,从成纤维细胞中进一步鉴定出以下细胞(簇1/2/3/5/8/9):与具有独特表型和功能的成纤维细胞有关的四个亚簇(sc)(sc1、5、6、7)和三个成骨细胞谱系细胞亚群,包括CD55+MSCs(sC2)、APOE+pre-OBs(sC3)和IBSP+OBs(sC4)(图2B)。已有大量文献证实了成纤维细胞在调节组织稳态、协调炎症反应和介导组织损伤方面的新的作用。从图2B中获得的四个不同的成纤维细胞亚群与理论一致,表明成纤维细胞在细胞外基质中表现出不同的身份并具有不同的作用。牙周膜成纤维细胞(PLF,sC1)占据了大多数由细胞外结缔组织标记物ASPN表达注释的成纤维细胞。在PDL中强烈表达(图2B)。有趣的是,四个亚群中的另外三个表达了炎症相关基因(CXCL1、CXCL13、LAMP5)(图2B)。在PD样本的牙周组织中观察到大量的CXCL1+、CXCL13+和LAMP5+亚簇(图2C)。
图 1. SnRNA-seq和scRNA-seq的多队列整合识别和表征HCC相关细胞类型
2. 初始牙周治疗后成骨细胞谱系的耗竭和成骨失败
在骨免疫学微环境中,MSCs具有成纤维细胞样形态的特征,可以分化成多种细胞类型,包括成骨细胞谱系细胞)。接下来使用流式细胞仪分选从临床健康供体的人类牙周组织中分离CD55+NT5E+LepR+或CD45-CD55+细胞。如预期的那样,CD55+NT5E+LepR+细胞具有MSCs的特征,并表现出体外多向分化潜能(图2D)。与D55+NT5E+LepR+细胞类似,CD55也可单独用于标记人牙周组织中的MSC。CD55+MSCs、APOE+pre-OBs和IBSP+OBs的比例在初始牙周治疗后显着降低(图2C)。新的的是,PDT组的MSC、pre-OBs和OBs几乎耗尽。使用来自HC和PD样本的牙周组织通过免疫荧光染色证实了CD55+LepR+MSCs的表达。在HC样本的牙周组织中检测到LepR+种群表面CD55的强烈表达,伴随着PD样本中CD55+LepR+种群的相对低表达(图2E)。进一步检查了疾病进展对牙周组织成骨细胞分化的影响。由于PDT中未检测到MSC,因此合并了所有参与者的数据,并进行了单细胞轨迹分析,以模拟MSC(sC2)、pre-OBs(sC3)和OB(sC4)之间的谱系联系。我们利用scVelo来确定成骨细胞谱系细胞的转录命运。将速率箭头投影到UMAP图上,将CD55+MSC的未来状态外推到前OB和OB种群(图2F)。Monocle拟时序分析进一步证实了MSC到Pre-OB和OB的转换。有趣的是,拟时序轨迹从MSCs开始,然后分成两个主要分支,OBs和pre-OBs放置在相反的不同末端,作为两种最终分化的细胞类型(图2F)。在轨迹的一端发现了OB,代表了从MSC到OB(命运1分支)的成功过渡。相反,在轨迹的另一个末端(命运2分支)发现了部分前OB。考虑到这一点,我们试图阐明区分这两个分支的分子动力学。基因表达动力学分析表明,与命运1分支一起,在过渡结束时激活的簇2基因主要参与“骨骼系统时尚”、“骨化”和“OB分化”。与POSTN、BMP3、BMP5和BMP8B成骨细胞分化的特征一致。命运2分支表达了更高水平的簇3基因,这些基因“胶原分解代谢过程”(CTSK、ADAMTS2和COL6A2)和“细胞外基质分解”(MMP14、COL3A1和COL6A1)(图2G-H)。因此,这些独特的基因表达模式表征了成功的OB分化路径和前OB亚群的功能差异。
3. 周细胞的多向分化能力
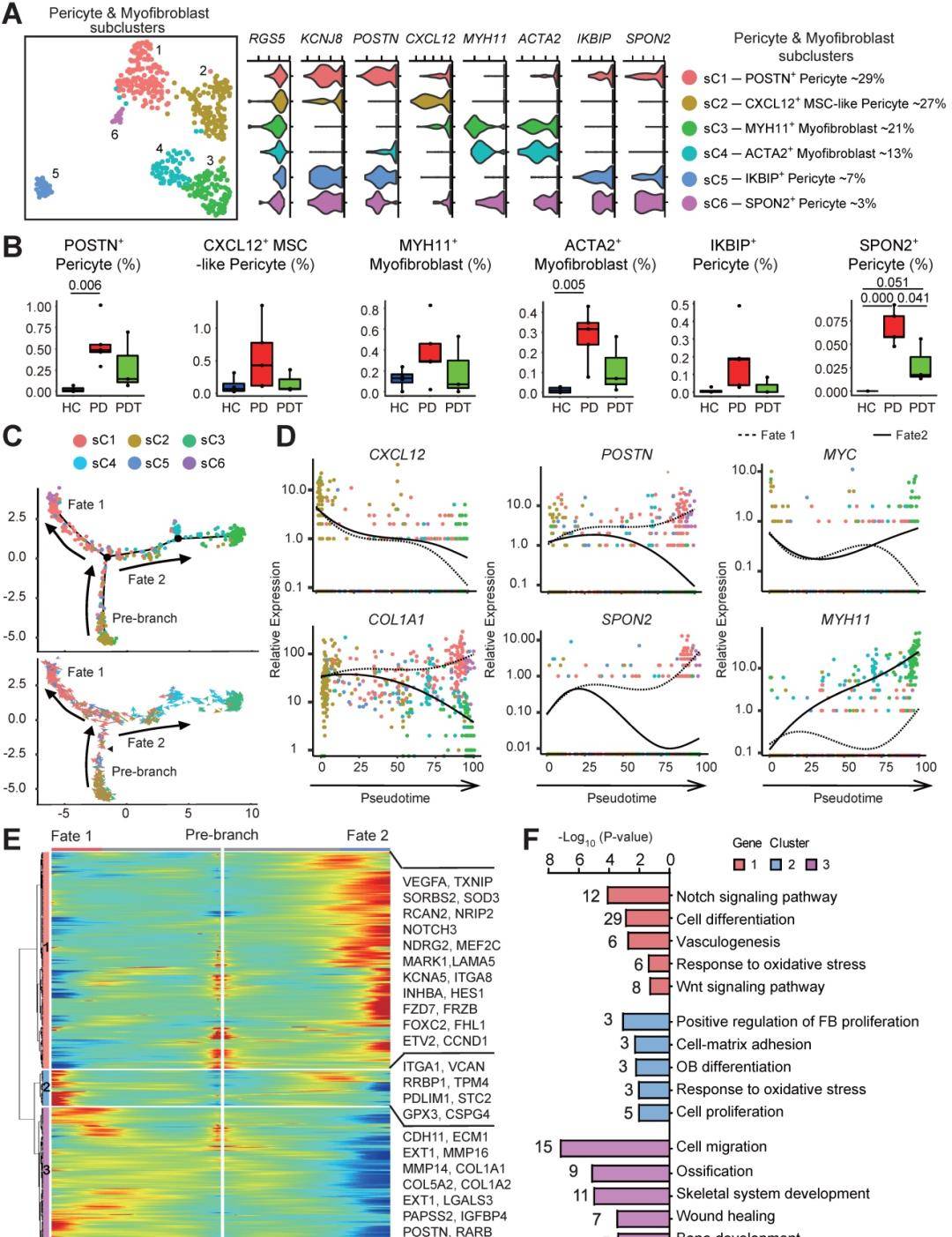
鉴于在初始牙周治疗后牙周组织中没有MSCs的成骨细胞谱系细胞显着减少,试图探索MSCs的其他来源。周细胞作为壁细胞保护血管完整性并具有自我更新的属性。作为多能成体干细胞,它们可以分化为多个谱系,用于组织修复和再生过程。值得注意的是,由于缺乏独特的标记,来自周细胞和肌成纤维细胞的单细胞数据被汇集起来,无监督聚类。我们注意到合并的周细胞和肌成纤维细胞均一地表达RGS5,但各个典型细胞谱系标记(图3A)和ACTA2表达肌成纤维细胞(亚群3和4)的表达模式和水平各不相同。还鉴定了四个转录不同的KCNJ8+周细胞亚群。其中,只有sC2表达高水平的CXCL12,CXCL12是血管周围MSCs的标志物。因此,将该亚群鉴定为CXCL12+MSC样周细胞。即使在初始牙周治疗后,CXCL12+MSC样周细胞仍然存在(图3B)。为了确定谱系联系和相应的基因表达,我们对合并的细胞进行了拟时序分析,以构建一个包含两个末端的新轨迹对应于两种不同的细胞命运。RNA速率分析用于明确展示轨迹(图3C)。在轨迹起点发现CXCL12+MSC样周细胞,然后分裂成两个主要分支POSTN+/SPON2+周细胞(命运1分支)和MYH11+/ACTA2+肌成纤维细胞(命运2分支)作为两种终末分化的细胞类型放置在相对的不同末端。值得注意的是,大多数CXCL12+MSC样周细胞未能通过承诺点(黑色三角形),并且过渡细胞显示出回到基础命运的倾向(图3C)。事实上,差异基因表达分析将这六个集群归因于不同的
子类型与拟时序状态一致。接下来,评估导致MSC样周细胞分化的基因表达模式。CXCL12是MSC和周细胞中关键的造血干细胞生态位因子的表达被发现在两种轨迹中相似,并且随着细胞分化而下调。COL1A1、POSTN和SPON2的表达在命运2分支期间下调,但在命运1分支期间显着上调(图3D)。进一步剖析了涉及连续过渡的基因表达模式。簇1基因的表达随命运2分支增加,GO分析“Notch信号通路”、“Wnt信号通路”和参与“TGF-β信号通路”的富集(FZD7、NOTCH3、INHBA和MYC)(图3E-F)。簇2和3基因在命运1分支中表现出分支依赖性富集,并参与“成骨细胞分化”、“骨化”和“骨骼系统时尚”(MMP14、COL1A1、IGFBP4和POSTN),表明具有成骨潜力。(图3D-F)。这意味着炎症刺激可能对两个方向都有新的贡献。
4. 牙周组织破骨细胞时尚的轨迹
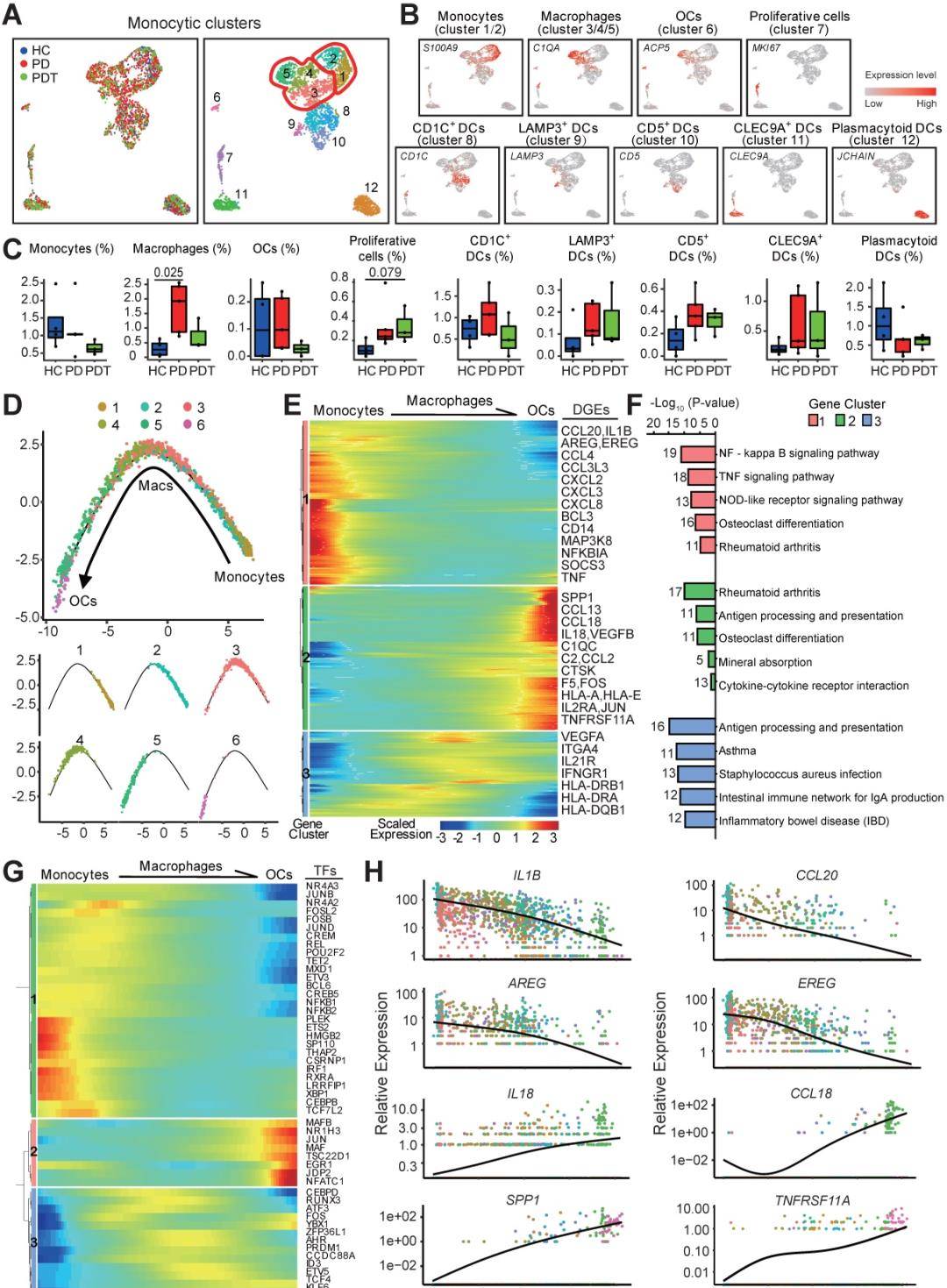
单核细胞、巨噬细胞、OC和树突状细胞(DC)是密切相关的单核细胞,其特点是能够感知和响应炎症和骨损伤。其吞噬特性和高可塑性受骨免疫学微环境异质性控制。在单核细胞簇内,我们发现两个单核细胞簇(簇1/2)、三个巨噬细胞簇(簇3/4/5)、一个OC簇(簇6)和具有独特标记的DC簇(图4A)。基于细胞类型标记基因的表达对组进行生物学注释(图4B)。与HC组相比,PD组的巨噬细胞比例显着增加,但在初始牙周治疗后部分获救(图4C)。在OC的比例中检测到类似的变化,但没有达到统计意义。这些数据可能表明初始牙周治疗通过抑制破骨细胞功能来预防额外骨质减少的功效。为了揭示OC谱系细胞的分化动态,我们重建了单核细胞簇(1/2)、巨噬细胞(簇3/4/5)和OC(簇6)的时尚轨迹。所有细胞都包含在一个细胞谱系中,没有任何分叉。有趣的是,在不同的分化阶段发现了三个巨噬细胞簇,而在轨迹末端附近发现了簇5(图4D)。此外,建议将具有高表达破骨细胞相关基因(ACP5、CD14、FCGR3A和ITGAV)的簇5作为破骨细胞前体细胞(OCP)(图4A-B)。进一步剖析了涉及连续过渡的基因表达模式。集群1和3基因在破骨细胞生成过程中受到抑制,但主要富集在炎症反应途径中。在破骨细胞生成的最后阶段激活的簇2基因在“OC分化”和“矿物质吸收”的途径中富集(图4E-F)。同时,与免疫细胞分化相关的转录因子,如HMGB2、BCL6和FOS,随着轨迹分化过程逐渐下调(图4G)。相反,一些破骨细胞相关因素,如
NFATC1、JUN、MAFB和JDP2在此过程中被上调(图4G)。此外,IL1B和CCL20的表达在单核细胞/巨噬细胞中高表达,而随着破骨细胞生成而降低(图4H)。EGFR配体基因AREG和EREG在单核细胞/巨噬细胞中过度表达,但在破骨细胞生成过程中减少(图4H),暗示单核细胞和巨噬细胞可能调节上皮细胞的增殖,尤其是在炎症状态下。新的的是,促炎细胞因子(IL18和CCL18)的表达在OCPs中高度表达,表明OCPs也可能具有免疫细胞功能(图4H)。正如预期的那样,OC相关基因SPP1和THFRSF11A在OCs中富集(图4H)。
5. 参与免疫反应的内皮细胞
鉴于炎症浸润增强,牙周病变中内皮细胞丰富(图1D)。我们从4461个内皮细胞和将它们分配给已知的内皮细胞类型(图5A)。PD组的两个不同组的相对百分比,即静脉内皮细胞(静脉EC,簇1/2/3/5/6/7/8)和动脉EC(簇4)的相对百分比高于HC组,并且与PD组相比,PDT组没有变化。我们还注意到PD组中淋巴ECs(簇10)的类似富集,尽管未检测到显着差异(图5A-C)。与HC组相比,PD组中增殖性ECs的比例也显着增加,并且在初始牙周治疗后得到部分挽救(图5C)。为了检查导致PD样本中ECs增加的转录因子,我们应用了单细胞调控网络推断和聚类(SCENIC)分析(方法)(图5D-E)。SOX17和TEAD3,可能参与动脉内稳态和炎症状态再生的转录因子,可能参与牙周微环境中动脉EC的变化(图5D-E)。我们还发现了几个在淋巴EC中特异性表达的未知调节因子(CREB3L1、PRRX1、MAFB和HOXA5)。与HC样品相比,PD样品中CREB3L1和PRRX1的表达均受到自身调节。相比之下,MAFB和HOXA5的表达方式相反。值得注意的是,在静脉内皮细胞中检测到AP-1转录因子家族(BATF、JDP2、JUN、FOSB和ATF3),其可能介导VEGF诱导的内皮细胞迁移和增殖。其中,JPD2和BATF在PDT样品中富集。随后,检查分泌因子的表达以探索微环境中静脉EC的潜在影响。值得注意的是,在PD与HC、PDT与PD以及PDT与PD的比较中,CSF3的表达水平上调(图5F)。
6. 牙周组织微环境中T细胞和B细胞的异质性
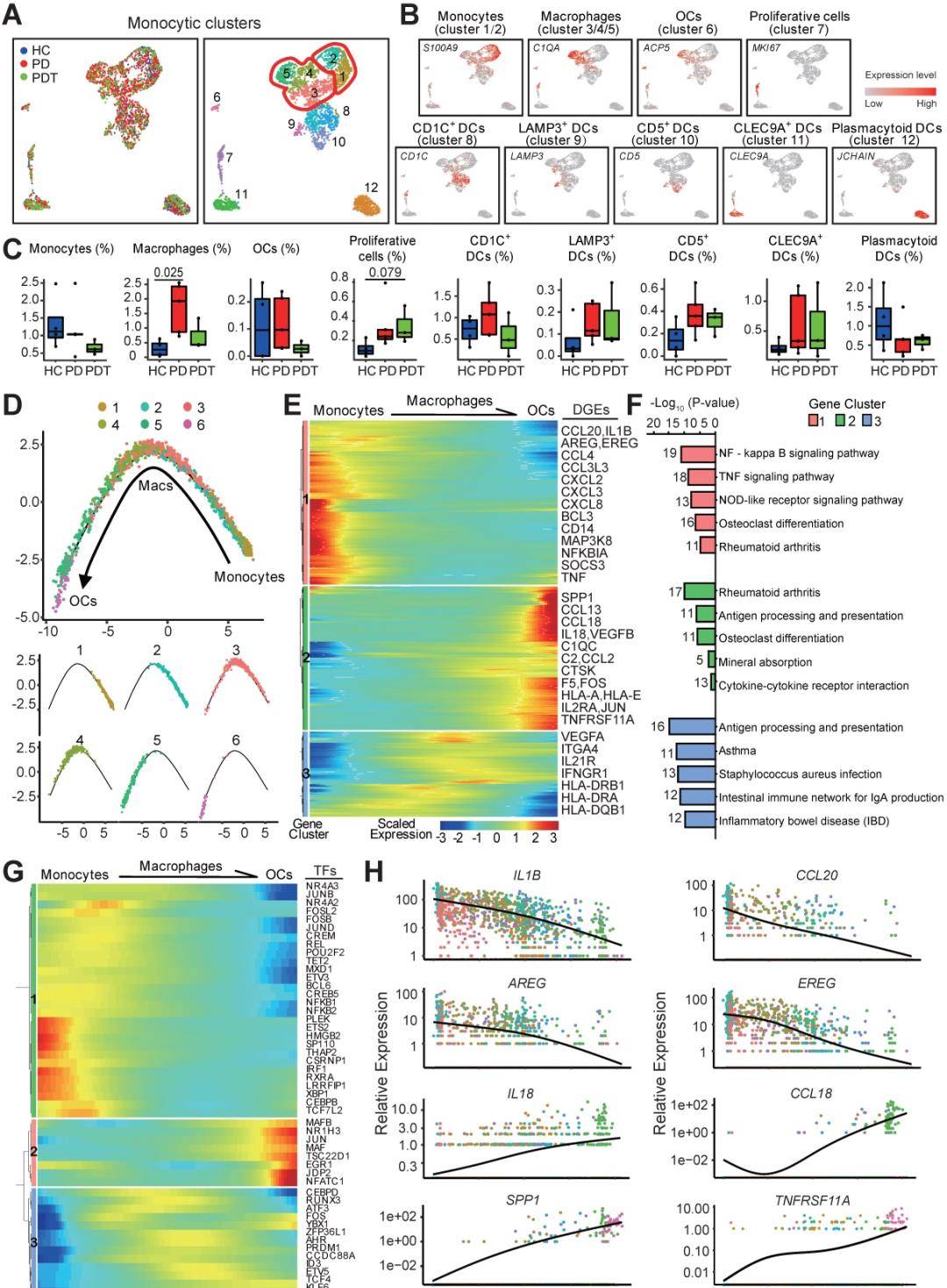
免疫细胞,尤其是T细胞和B细胞,被认为是慢性炎症的新的调节因子。据报道,浆细胞约占牙周炎病变细胞的50%,而B细胞约占18%。B的比例在这些病变中,细胞大于T细胞。然而,在本研究中,B细胞和浆细胞的比例相对低于T细胞,但与其他细胞类型相比数量相当可观。因此,我们进一步分析和分析了T细胞、B细胞和血浆牙周组织微环境中的细胞(图6)。T(NKT)细胞、CD4+T细胞和CD8+T细胞(图6A-B)。鉴定出六个CD4+T细胞亚群(图6C),包括CD4+效应记忆(TEM)/TH1样细胞(14%)、CD4+2023记忆T(TCM)细胞(32.79%)、CD4+naïveT(TN)细胞(11.92%)、Treg细胞(13.34%)、滤泡辅助T(TFH)细胞(19.05%)和TH17细胞(8.90%)。尽管这些CD4+T细胞亚群可能在牙周组织的微环境中发挥不同的功能,但在牙周炎过程中未检测到统计学意义。我们进一步鉴定了七个不同的CD8+T细胞亚群(图6D),包括黏膜相关不变T细胞(MAIT,7.04%)、CD8+TCM细胞(8.69%)、CD8+TEffector细胞(39.42%)、CD8+终末分化效应T(TEMRA)细胞(17.12%)、CD8+TN细胞(10.02%)、CD8+组织驻留记忆T(TRM)细胞(9.11%)和γδT细胞(8.60%)。值得注意的是,与HC组相比,PD组中T细胞减少,CD8+TRM细胞似乎增加,而与HC组相比,PD组中MAIT和CD8+TEMRA细胞显着减少(图1D)。有趣的是,基因集富集分析揭示了各种信号通路——包括NOD样受体信号通路、Th17细胞分化、细胞凋亡、IL-17信号通路、TNF信号通路和破骨细胞。与HC组相比,PD组中大多数CD8+T细胞亚簇的分化增加(图6E)。与PD组相比,大部分上述途径在PDT组中部分升高(图6E)。此外,这两项分析都对功能评分和伤亡炎症小体进行了分析。此外,在CD8+T细胞亚群中检测到可能诱导对T细胞活化的抑制反应的关键免疫检查点基因,例如,PDCD1、CTLA4、TIGIT、CD96和CD44)(图6F)。最后,观察到三个转录不同的B细胞亚群(图6G-I),包括活化B细胞(ABC)(8.41%)、记忆B细胞(50.55%)和幼稚B细胞(41.04%)。
7. 牙周组织免疫学微环境中的细胞间通讯
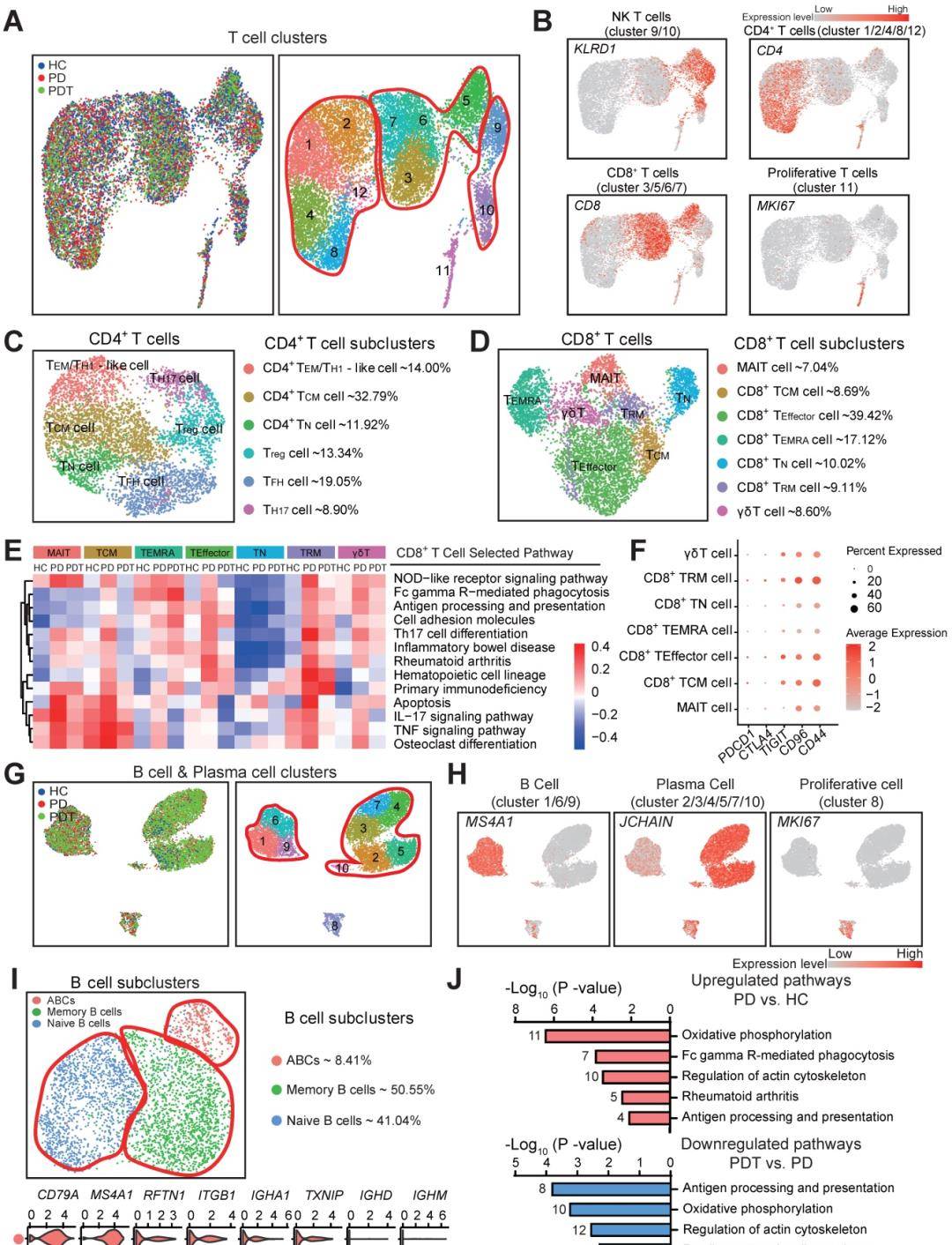
骨免疫学微环境中的免疫细胞和免疫细胞将揭示牙周炎中骨稳态的机制和炎症性骨溶解的发病机制。因此,我们使用CellPhoneDB(方法)来识别图1所示主要细胞类型中的配体-受体对,以探索可能的分子相互作用。对于同源受体检测到配体并展示(图7A和图S10)。值得注意的是,内皮细胞与其他细胞类型的相互作用最多,其次是成纤维细胞、单核细胞和上皮细胞。随后,我们比较了HC、PD和PDT组之间的配体-受体相互作用对。总的来说,我们在来自HC、PD和PDT组的样本中鉴定了91699个配体-受体相互作用对。有26942对三组中的共同点。HC、PD和PDT组中分别有13018、13047和13784个独特的配体-受体相互作用对(图7B)。在成骨细胞生成(如Wnt、BMP、PDGF、FGF和NOTCH信号传导)中观察到前OB与其他细胞类型之间最特异性的相互作用,并且在成骨细胞中更丰富。PD组高于HC组或PDT组(图7C)。值得注意的是,PD组中的pre-OBs表达了相对较高水平的NOTCH受体,而相应的配体在内皮细胞中广泛表达,表明在成骨细胞生成过程中,前OB和EC之间存在强烈的相互作用。除了那些常见的相互作用外,还检测到了在牙周炎中很少报道的富含Ephrin-Eph信号的受体-配体对。CellPhoneDB分析显示受体-配体对的相互作用明显增加EC和Pre-OB之间的Ephrin-Eph信号传导,例如EFNA1-EPHA7、EPHA2-EFNA5、EPHA4-EFNB3、EPHA4-EFNA5和EPHB4-EFNB3(图7D-E)。接下来检查了表达EphrinA1的ECs(CD31+)和表达EphA7的Pre-OBs(ALP+)之间的解剖联系在来自HC和PD样品的牙周组织中,使用石蜡切片上的四重免疫荧光(IF)染色。我们在来自HC组的样本中观察到牙槽骨表面上的大量EphA7+ALP+Pre-OB。相比之下,EphA7+ALP+PD样本中的前OB数量显着减少,并且检测到大量表达EphrinA1的EC(图7F)。
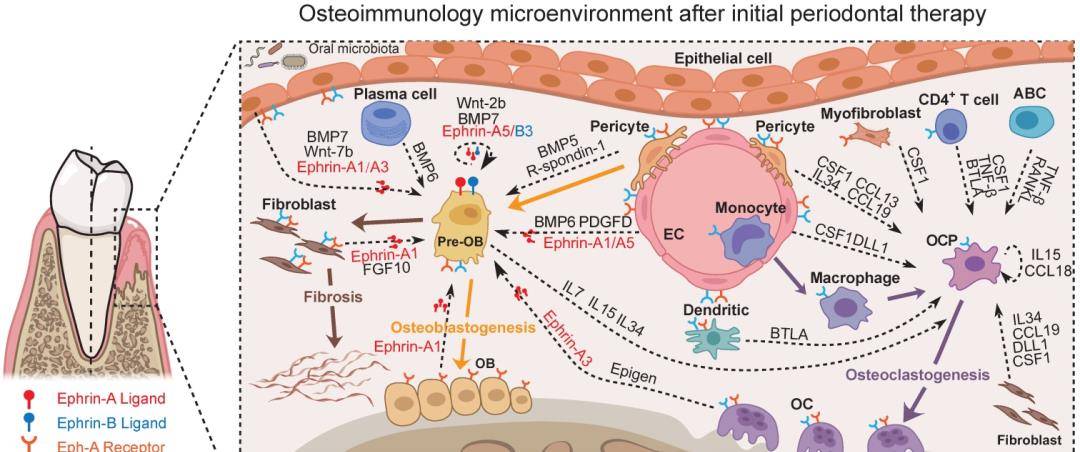
总结:以初始牙周治疗后牙周组织骨免疫微环境为中心的预测调控网络。
- 本文固定链接: https://maimengkong.com/zixun/1500.html
- 转载请注明: : 萌小白 2023年4月30日 于 卖萌控的博客 发表
- 百度已收录