
党参Codonopsis pilosula (Franch.) Nannf.是桔梗科多年生草本植物,以干燥根入药,主治脾肺气虚、食少倦怠、咳嗽虚喘、心悸气短、内热消渴等症[1]。在降低血压、提高免疫力、保护血管、改善微循环、增强造血功能等方面疗效显著[2-3]。党参多糖(conopsispolysaccharides,CPPs)是其发挥免疫活性的主要成分,主要由单糖及其衍生物组成,其生物合成主要由UDP-半乳糖、UDP- L - 阿拉伯糖、UDP-鼠李糖、GDP-甘露糖等单糖组成的氨基糖和核苷糖代谢途径(amino sugar and nucleotide sugar metabolism,ko00520),蔗糖、UDP-葡萄糖和果糖组成的淀粉和蔗糖代谢途径(starch and sucrose metabolism,ko00500)以及糖酵解/糖异生代谢途径(glycolysis/gluconeogenesis,ko00010)联合作用[4]。
党参在我国主要分布于西北干旱和半干旱地区,在西北地区主产于甘肃渭源、陇西等地[5]。目前党参的研究主要集中于本草考证、商品资源以及化学成分和药理作用等方面[6-8],在植物的非生物胁迫方面研究较少,而干旱胁迫是影响党参生长发育和品质形成的重要因素,课题组前期研究发现党参可通过调节渗透物质含量和抗氧化酶活性抵御干旱[9],在药效成分合成方面,仅有王赞文[5]研究发现,适度水分处理有助于党参地上部分与根中多糖和党参炔苷的积累,重度干旱则促进其苍术内脂Ⅲ的生物合成,轻度干旱有助于丁香苷的积累,表明干旱胁迫对党参代谢物质的积累作用显著。
转录组测序技术(RNA-seq)能够量化基因的表达,挖掘生物重要功能基因,是培育物种优良性状和基因功能的重要手段。现已被用于植物逆境胁迫的相关研究中,如张大燕等[10]对乌头根、茎、叶等组织进行转录组分析,发现其萜类生物碱的合成代谢受干旱因素的调控;渠萌[11]利用测序筛选出干旱胁迫对甘草黄酮类有效成分合成相关的基因,通过生信分析,初步揭示了干旱胁迫对甘草基因表达的调控;李晓艳等[12]通过RNA-seq揭示了适度干旱胁迫对丹参不同组织基因表达的调控特征。但从转录组水平解析干旱对党参各部位的基因表达调控鲜见报道,因此本实验以党参为研究对象,在4种干旱胁迫处理下,利用RNA-seq技术测定生长旺盛期党参根、茎、叶中基因表达情况,通过数据库注释探寻差异基因和代谢通路,探索干旱对党参根、茎、叶组织中差异基因表达的影响以及对党参多糖合成相关基因的调控,以期为从分子水平改善党参品质、培育优质党参提供理论基础。
1材料
本研究所用党参种苗来自甘肃省渭源县清源镇党参种植基地,经甘肃中医药大学杜弢教授鉴定为党参C. pilosula (Franch.) Nannf.。
2 方法
2.1试验设计
于2020年4月5日选取均匀一致的党参种苗移植到营养钵培育,待6月15日选取长势一致的党参进行控水处理,共设置4个水分梯度,分别为对照(CK)、轻度干旱(LD)、中度干旱 (MD)、重度干旱(SD),各占田间最大持水量的85%~90%、65%~70%、50%~55%、35%~40%。为避免受其他因素干扰,实验全程在大棚内进行,并在干旱处理后每天18:00左右进行称定质量,补充损失水分,控制水分保持在指定范围。至8月中旬党参生长旺盛期,分别取4个处理下党参根、茎、叶组织作为实验材料,各3次重复,共36个样本,用蒸馏水清洗干净后,吸水纸吸干表面水分,迅速放于液氮中冻存,当天带回实验室后转入−80 ℃冰箱保存备用。根据取样组织和干旱处理分别编号分别为叶对照(LC)、叶轻度干旱(LLD)、叶中度干旱(LMD)、叶重度干旱(LSD);茎对照(SC)、茎轻度干旱(SLD)、茎中度干旱(SMD)、茎重度干旱(SSD);根对照(RC)、根轻度干旱(RLD)、根中度干旱(RMD)、根重度干旱(RSD)。
2.2 RNA提取、cDNA文库构建与测序
总RNA采用植物RNA试剂盒mirVana™ miRNA ISOlation Kit(Ambion-1561美国)提取,通过Agilent 2100 Bioanalyzer(Agilent,Santa Clara,美国)检测其纯度、浓度和完整性。与上海欧易生物医学科技有限公司合作进行转录组建库与测序工作,具体步骤为提取样品总RNA并使用DNase消化DNA后用带有Oligo(dT)的磁珠富集mRNA;加入打断试剂将mRNA打断成短片段,以打断后的mRNA为模板,用六碱基随机引物合成一链cDNA,然后配制二链合成反应体系合成二链cDNA,纯化的双链cDNA再进行末端修复、加A尾并连接测序接头,然后进行片段大小选择,最后进行PCR扩增;构建好的文库质检合格后使用Illumina HiSeqTM 2500进行测序。
2.3 De novo组装及功能注释
党参基因序列全长目前未知,在不依赖参考基因组的情况下,将有overlap的reads连接成一个更长的序列,经过不断的延伸,拼接成tran,根据序列相似性以及长度,挑选出最长的一条作为Unigene;之后再利用CD-HIT软件聚类去冗余得到一套最终的Unigene,以此作为后续分析的参考序列。利用diamond软件将Unigene比对到非冗余数据库(non-redundant protein sequence database,NR)、真核生物蛋白相邻类的聚簇(clusters of orthologous group for eukaryotic complete,KOG)、基因本体联合会(gene ontology,GO)、Swiss-prot、eggNOG、京都基因与基因组(Kyoto Encyclopedia of genes and genomes,KEGG)数据库以及利用HMMER软件比对Pfam数据库来进行Unigene的功能注释。
2.4 差异基因分析
本实验共设置9个差异分组,分别为叶LLD vs LC 、LMD vs LC 、LSD vs LC ;茎SLD vs SC 、SMD vs SC 、SSD vs SC ;根RLD vs RC 、RMD vs RC 、RSD vs RC ;利用DESeq软件对各个样本基因的counts数目进行标准化处理(采用BaseMean值来估算表达量),计算差异倍数,并采用NB(负二项分布检验的方式)对reads数进行差异显著性检验,最终以FC>2和P<0.05为截止值,来筛选差异蛋白编码基因(DEGs)。
2.5 qRT-PCR表达量验证
提取总RNA,然后利用试剂盒将待测RNA逆转录成cDNA。逆转录完毕后加入90 μL Nuclease-free H 2 O 储存在−20 ℃冰箱备用。设计好引物后(表1),利用PerfectStartTM Green qPCR SuperMix试剂盒在LightCycler® 480 II型荧光定量PCR仪(Roche,Swiss)上进行反应。PCR程序:94 ℃、30 s;94 ℃、5 s,60 ℃、30 s,45个循环。循环结 束后利用熔解曲线检测产物特异性:从60 ℃缓慢升温至97 ℃,采集荧光信号5次/℃。最后采用2-∆∆ C t 法计算表达量。本实验采用肌动蛋白(ACT)酶作为内参基因并选4个Unigene进行表达量验证。
3结果与分析
3.1测序与功能注释
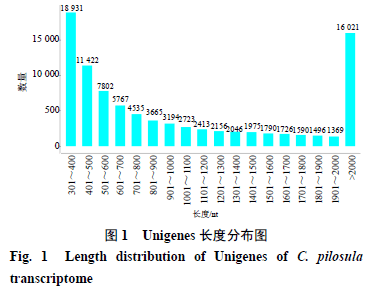
为全面研究干旱胁迫下党参根、茎、叶转录组特征。36个样本经过测序共获得250.41 Gb clean data,各样本的有效数据量分布在6.61~7.33 G,Q30碱基分布在95.1%~96.2 %,平均GC含量为45.59%,说明测序结果准确度较高,可以用于后续分析。拼接出Unigene 60 377条,总长度为106 848 387 bp,平均长度为1 179.07 bp。Unigene组装长度分布如图1所示,序列长度主要集中于300~2000 nt,大于2000 nt的序列占总序列的21.5%,其分布符合预期测序结果。
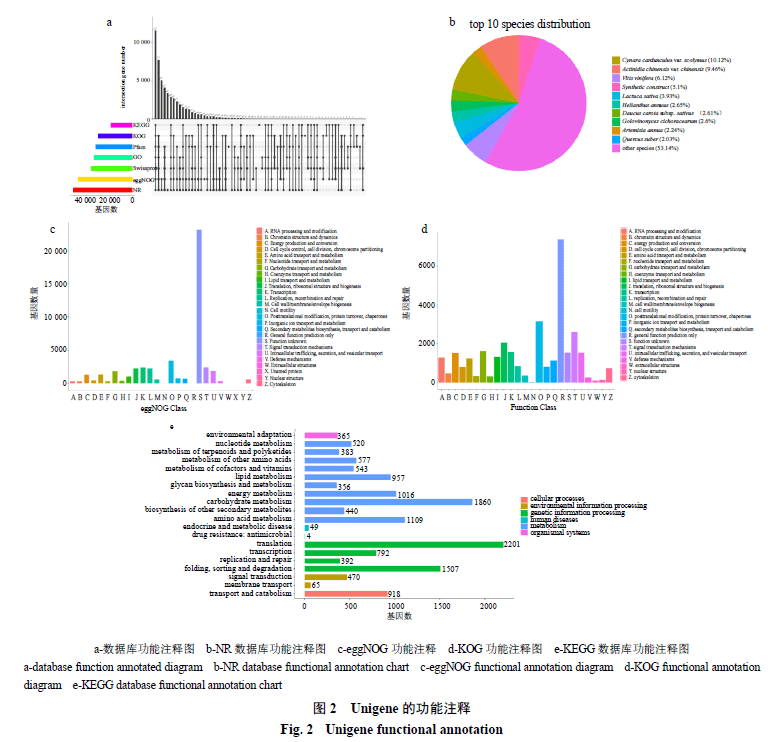
将拼接得到的Unigene注释到功能数据库,结果见图2。按照注释比例发现,注释到NR库基因最多,有51 477条(56.80%),其中NR数据库注释到基因同源物种分布图显示注释到菜蓟的Unigene最多,占10.12%。在eggNOG、Swissprot库分别有47 378条(52.28%)和35 912条(39.63%)基因显著匹配,其中eggNOG分为26个特定类别,包含基因最多的是翻译后修饰、蛋白质转换和伴侣(3468条),其次是信号转导机制类别(2431条)和转录(2256条);在GO库中33 479条(36.94%)基因被分为3大类:生物学途径(27 646条)、分子功能(28 710条)、细胞学组件(29 983条);31 833条(35.13%)基因注释到Pfam;18 649条(32.99%)基因注释到KOG库;注释到KEGG库有18 649条(20.58%)基因,分配到代谢水平的基因最多(7 761条),其中碳水化合物代谢(1860条)、氨基酸代谢(1109条)和代谢能量(1016条)所占比例较高,其次是脂质代谢(957条)、核苷酸代谢(520条)和其他氨基酸代谢(577条),辅助因子和维生素的代谢(543条)、萜类聚酮类代谢(383条)、聚糖的合成与代谢(356条)以及其他次生代谢产物的生物合成(440条)占一定比重。
3.2 干旱胁迫下党参差异基因表达分析
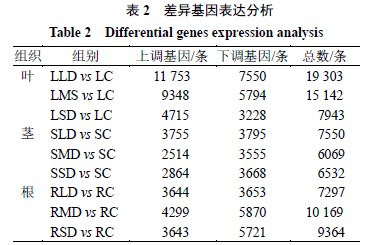
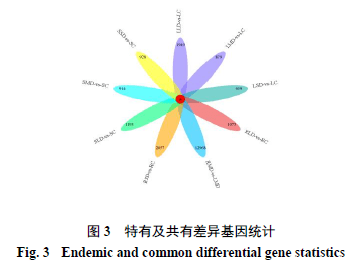
本实验叶、茎、根组织中分别有42 388、20 151、26 812条DEGs响应干旱胁迫,见表2。叶中以上调为主有25 816条,上调基因中LLD 4715条、LMD 11 753条、LSD 9348条,茎和根中均以下调基因为主各11 018条、15 244条。各组DEGs上下调情况如表1所示,进一步分析发现,9组均含有特有基因(图3),其中叶LLD vs LC 组1949条、LMD vs LC 组879条、LSD vs LC 组619条;茎SLD vs SC 组1193条、SMD vs SC 组914条、SSD vs SC 组928条;根RLD vs RC 组1073条、RMD vs RC 组1968条、RSD vs RC 组2057条。9个差异组共有DEGs 26条。
3.3 干旱胁迫下党参差异基因GO功能富集
差异基因聚类分析可寻找差异表达基因的聚类模式,比较不同样本组合之间的差异倍数。对DEGs进行GO富集分析,发现其中一部分基因具有重要的生物信息学功能,并对其进行GO功能分类(图4)。
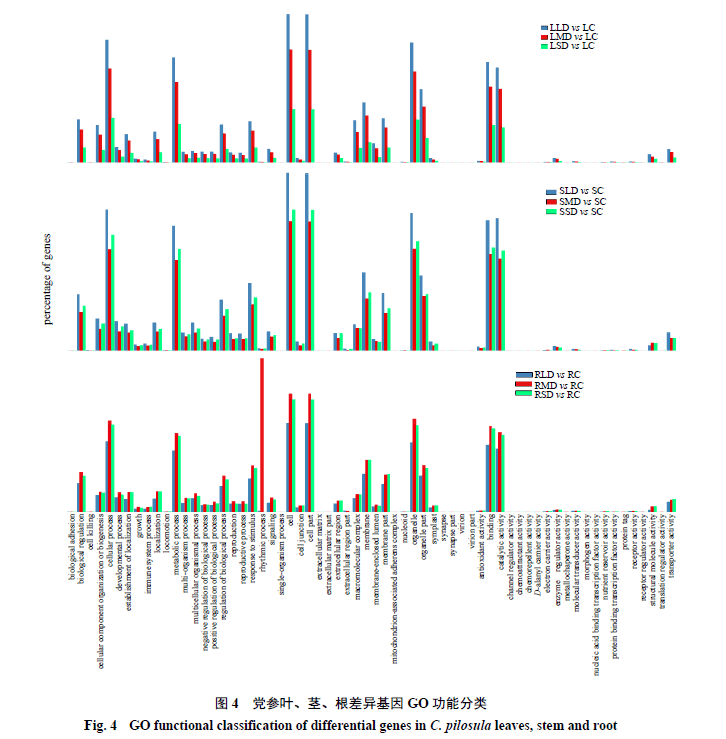
从图中可以看出细胞学成分(cellular component)类DEGs均主要集中于细胞(cell)和细胞部分(cell part)以及细胞器(organelle)和细胞器部分(organelle part);生物学过程类(biological processes)DEGs均主要集中于细胞过程(cellular process)和代谢过程(metabolic process);分子功能类(molecular function)DEGs主要集中于结合蛋白(binding)和催化活性(catalytic activity)。叶和茎的轻度干旱 胁迫(LLD、SLD)下DEGs占比最多,而根中度干旱胁迫(RMD)DEGs占比较高。值得注意的是,节律过程(rhythmic process)相关DEGs在RMD中占比最高,表明中度干旱胁迫下,节律过程可能在调节党参根代谢过程和抵御干旱的生理过程发挥重要作用。
3.4 干旱胁迫下党参差异基因KEGG功能富集
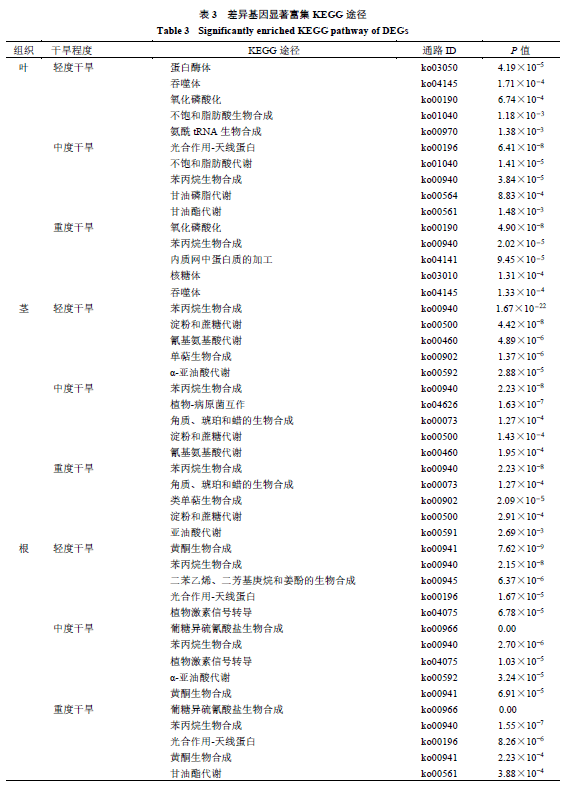
对筛选得到的DEGs 进行KEGG途径分类分析发现其主要归于碳水化合物代谢(carbohydrate metabolism)、能量代谢(energy metabolism)、氨基酸代谢(amino acid metabolism)、脂质代谢(lipid metabolism)、其他氨基酸代谢(metabolism of other amino acids)、辅因子和维生素代谢(metabolism of cofactors and vitamins)、核苷酸代谢(nucleotide metabolism)、其他次生代谢产物生物合成(biosynthesis of other secondary metabolites)、萜类化合物和聚酮类化合物的代谢(metabolism of terpenoids and polyketides)、聚糖的生物合成和代谢(glycan biosynthesis and metabolism)10大类。此外,通过对全部差异Unigene(包括上调和下调)进行KEGG功能富集,筛选出各差异分组中前5名的差异代谢通路(表3)。表明干旱胁迫处理下,表中代谢通路中差异Unigene受干旱影响显著。
3.5干旱胁迫对党参多糖合成相关酶基因的调控
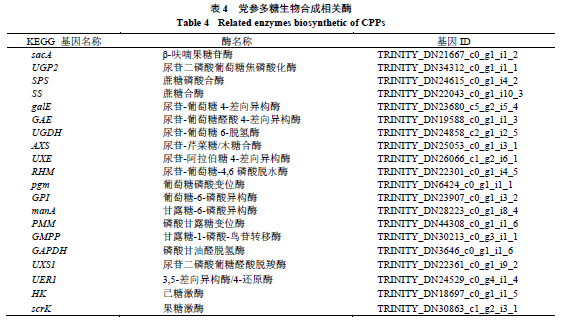
党参多糖的合成主要依赖于淀粉和蔗糖代谢(ko00500)、氨基糖和核苷糖代谢(ko00520)以及糖酵解/糖异生代谢通路(ko00010)[4](图5)。通过KEGG map分析并结合前人研究发现干旱胁迫下有20个编码酶基因在多糖代谢中发挥重要作用(表4),并且这些酶基因在党参不同组织和不同干旱胁迫程度下均存在差异表达(图6)。
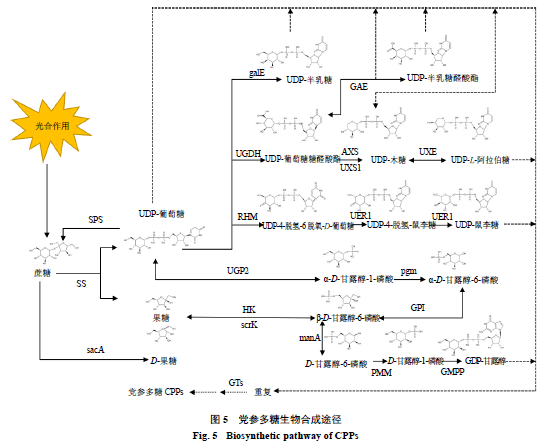
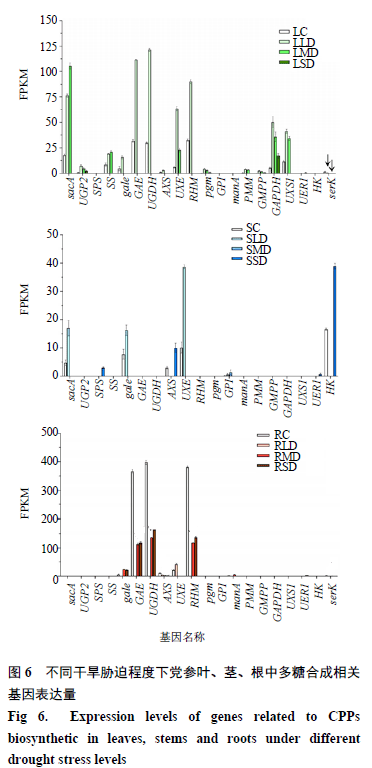
3.5.1淀粉和蔗糖代谢途径UGP2酶是党参多糖生物合成过程中的关键酶,UGP2可以和SS、SPS相互作用调控植物体内蔗糖的合成与代谢,本实验中编码UGP2的基因在叶中上调,且表达量LLD高于LMD高于LSD,推测干旱胁迫正调控该基因的表达参与叶中蔗糖合成。编码SS的基因在茎和根中无差异表达,在叶LLD和LMD中上调,编码SPS的基因在SSD中上调表达。并且在该通路中蔗糖能在sacA的催化下生成D-果糖,然后经过HK和scrK进一步催化生成β- D - 果糖-6磷酸,参与后续物质的合成,转录组数据中编码sacA的基因在叶中上调高表达且LMD高于LLD,即干旱胁迫正调控党参sacA表达。
3.5.2 核苷糖和氨基糖代谢途径在核苷糖和氨基糖代谢通路中UDP-葡萄糖分别通过4个支路分解为UDP-半乳糖,UDP-葡萄糖醛酸酯、UDP-半乳糖醛酸酯、UDP-木糖、UDP-阿拉伯糖、UDP-鼠李糖以及GDP-甘露糖,主要涉及15个相关酶。其中UGDH、GAE和RHM编码基因显著高表达,在醛酸酯合成支路中编码UGDH的基因、编码GAE的基因和在UDP-鼠李糖合成支路中编码RHM的基因中均在LLD中上调高表达,推测轻度干旱胁迫能正调控UGDH和RHM编码基因从而激活酶活性催化UDP-葡糖糖分解为UDP-葡萄糖醛酸酯和UDP-4-脱氢-6-脱氧- D - 葡萄糖,并进一步调控GAE酶基因催化UDP-葡萄糖醛酸酯和UDP-半乳糖醛酸酯的转 化。叶LLD、茎SLD以及根RMD、RSD处理下g alE均呈现上调趋势,有利于UDP-半乳糖的合成。此外,AXS基因在LLD和SSD中上调表达,UXS1基因在LLD和LMD中上调表达,UXE基因在LLD、LMD、SLD、RLD中均上调高表达,推测轻度胁迫下AXS和UXS1协同促进叶中UDP-木糖的合成,重度胁迫下AXS发挥主要作用,然后进一步在UXE的催化下正调控根、茎、叶中UDP- L - 阿拉伯糖的合成。
GDP-甘露糖支路中的酶基因多表现为上调,且具有明显的组织差异性,编码PMM的基因、编码GMPP的基因和编码pgm基因在叶中特异性表达,且LLD高于LMD高于LSD;编码GPI基因表达量较低且仅在茎中存在差异表达;编码manA的基因基因仅在RMD中上调。推测干旱胁迫对多糖合成前体物质甘露糖合成具有一定程度的促进作用。
3.5.3糖酵解/糖异生途径GAPDH 主要存在细胞质中以同型四聚体形式在糖酵解途径中发挥作用,本试验中其编码基因在叶中特异性上调表达,且表达量LLD高于LMD高于LSD,推测干旱胁迫正调控该基因在叶中的表达,且轻度干旱对其表达量影响最大。
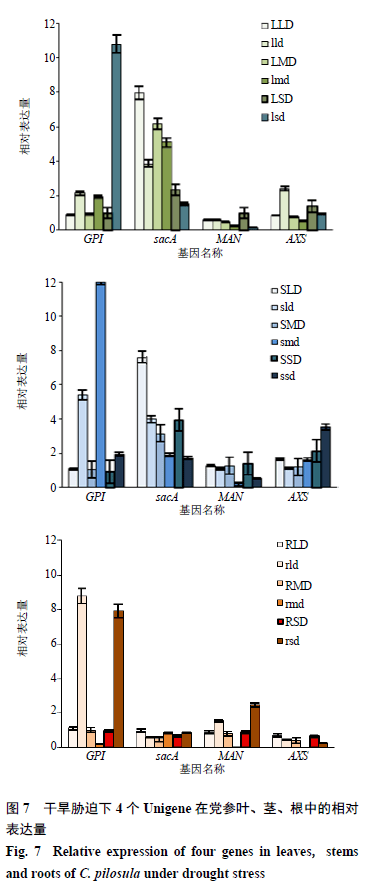
3.6 qRT-PCR 表达量验证
为保证试验结果的可靠性,从党参转录组数据中选取4个党参糖类成分合成相关的酶基因(GPI、SacA、MAN、AXS),进行qRT-PCR表达量验证(图7,LLD、LMD、LSD、SLD、SMD、SSD、RLD、RMD、RSD为PCR验证组lld、lmd、lsd、sld、smd、ssd、rld、rmd、rsd为测序组),图中可以看出,转录组测序基因FC变化趋势与PCR验证结果基本一致。
4 讨论
干旱是影响植物生长发育的主要限制因子之一,植物在响应干旱胁迫过程中涉及一些功能基因和调节基因的差异表达,形成了系列复杂的信号调控网络。现代研究通过转录组测序技术能够量化基因的表达,挖掘出生物重要功能基因,是培育物种优良性状和基因功能的重要手段[13]。
本研究通过RNA-seq技术对轻度、中度、重度干旱胁迫下的党参叶、茎、根组织进行转录组测序和差异基因表达分析,对筛选得到的DEGs进行GO功能富集发现干旱胁迫下党参DEGs在细胞、细胞部分、细胞过程、代谢过程、结合蛋白、催化活性等功能显著富集,和适度干旱下丹参的GO功能富集结果相似[12]。
植物通过光合作用合成蔗糖,蔗糖含量与SS和SPS密切相关,SS能进一步将蔗糖分解,催化UDP+蔗糖⇌UDP-Glc+果糖之间葡萄糖基的可逆转移,还能影响植物非生物逆境响应[13-14],可通过调节酶活性改善糖含量[15]。SPS是植物蔗糖生物合成途径中的关键速率限制酶,Huang等[16]研究发现该基因的表达能促进木薯植物根中淀粉的积累。UGP2是一种葡萄糖基供体,在高等植物中以活化糖形式存在[17],在叶片中能通过已经催化生成的尿苷二磷酸葡萄糖(UDPG)提供给SPS或SS合 成蔗糖,在 库组织中能 催化UDP-葡萄糖生成淀粉和蔗糖代谢通路中的中心成分α- D - 葡萄糖-1-磷酸[18]。Ciereszko等[19]研究发现拟南芥离体叶片中添加蔗糖或低温处理下编码UGP2的基因上调表达,本实验与其结果相似。UDP-葡萄糖和果糖再经过一系列的催化分解成UDP-半乳糖、UDP-木糖、UDP- L - 阿拉伯糖、UDP-鼠李糖、GDP-甘露糖等,这些糖在各种糖基转移酶的催化下循环往复进一步合成CPPs [4]。此外,糖酵解/糖异生途径在CPPs的单糖合成过程中发挥重要作用,其中GAPDH为糖代谢过程中关键酶基因并常用作内参基因,前人研究表明,干旱胁迫下GAPDH的表达与党参多糖的积累有一定的相关性[20],该酶基因的功能与党参抗旱性具有一定的联系。
本实验轻度干旱处理下叶中编码UGDH、GAE、RHM的基因显著高表达,其次AXS、UXE、UXS1基因也均上调表达,推测轻度干旱促进叶中UDP-葡萄糖的代谢和党参多糖合成前体物质UDP-葡萄糖醛酸酯合成以及UDP-半乳糖醛酸酯的合成与转化,并且UXS1与AXS协同催化UDP-木糖的合成,UXE进一步催化UDP- L - 阿拉伯糖的合成与转化,RHM则催化UDP-鼠李糖合支路UDP-4-脱氢-6-脱氧- D - 葡萄糖合成,表明轻度干旱对叶组织中上述多糖合成酶基因影响显著。整体数据表明轻度干旱胁迫正向调控叶中CPPs合成酶基因,也影响茎中部分CPPs合成酶基因,但是干旱胁迫对根中CPPs合成酶基因影响多表现为负调控,由于党参多糖的合成是涉及整个植株的复杂过程,推测本实验中干旱条件不利于根中多糖前体物质的合成,单糖的合成主要发生在叶中,干旱胁迫下糖类物质通过光合作用分解为多种单糖,后经茎部向根组织传输并在多中糖基转移酶的作用下转化为多糖在根中积累。
目前对党参的干旱胁迫分子响应机制研究较少,可供参考的遗传信息较少,在一定程度上限制了党参功能基因的挖掘。本研究获得了党参叶、茎、根的转录组信息,比较每种组织的轻度、中度、重度干旱胁迫下的DEGs的表达情况和功能,尤其是调控党参多糖合成相关酶基因的表达差异性,为进一步揭示党参多糖合成机制和培养优质党参提供基因依据。
利益冲突所有作者均声明不存在利益冲突
参考文献(略)
来 源:孙晓琛,栗锦鹏,原静静,王惠珍.基于转录组测序分析干旱胁迫对党参不同组织基因表达的调控 [J]. 中草药, 2022, 53(14): 4465-4475 .
- 本文固定链接: https://maimengkong.com/zixun/1372.html
- 转载请注明: : 萌小白 2023年2月5日 于 卖萌控的博客 发表
- 百度已收录
