前言
2020年10月大连化物所许国旺研究员团队与上海交通大学附属第六人民医院贾伟平教授团队、中科院上海生命科学研究院吴家睿研究员团队合作在Advanced Science期刊上发表题为“Multiplatform Metabolomics Reveals Novel Serum Metabolite Biomarkers in Diabetic Retinopathy Subjects”的研究成果。本研究共纳入905名受试者的血清样本,基于多平台代谢组学数据(GC-MS、LC-MS和LC-MS脂质组),全面地揭示了糖尿病视网膜病变发生发展过程中异常的代谢特征和紊乱的代谢途径。通过多变量/单变量统计分析,研究人员发现并验证了一个新型组合标志物(12-HETE和2-piperidone),实现了糖尿病视网膜病变的快速、精准的体外诊断。该组合标志物在疾病的早期诊断中也表现出明显优势。该研究为糖尿病视网膜病变血液检测提供了可靠、高效、便捷的新方法。

中文标题:多平台代谢组学揭示糖尿病性视网膜病变受试者的新型血清生物标志物
研究对象:人血清
发表期刊:Advanced Science
影响因子:15.84
发表时间:2020年8月
发表单位:中国科学院大连化学物理研究所
运用生物技术:非靶向代谢组(GC-MS、LC-MS和LC-MS脂质组)
研究背景
糖尿病性视网膜病变(DR)作为糖尿病(DM)最主要的眼部微血管并发症,是DM病人致盲的主要原因之一。国际糖尿病联盟(2015年)估计,到2030年,DR和威胁视力的糖尿病性视网膜病变(vision-threatening DR)的发病人数将分别增加至191.0和5630万。DR的筛查和早期诊断在预防和治疗该疾病中尤其重要。尽管在临床中通常使用视网膜成像方法来筛查和诊断DR,并成功降低了视力丧失率,但当前的DR筛查仍然面临着评估视网膜图像的主要医护人员可用性的问题。因此,需要有效的方法以防止疾病发展,如可靠的生物标志物来筛查DR。在明显的临床DR发生之前,可能会发生视网膜血管和神经损伤,并伴有微动脉瘤和渗出液出现在视网膜水肿上。血红蛋白A1c(HbA1c)是DR病程中唯一经过验证的全身性生物标志物;然而,HbA1c仅解释了6.6%的视网膜病变风险。因此,仍然迫切需要鉴定用于DR筛选或检测的新型生物标志物。
这项研究的目的是从多个分析平台获取代谢谱数据,以全面阐明与DR发生和发展相关的异常代谢,并进一步确定可靠的血清生物标志物,以诊断糖尿病人群的DR和早期DR。
研究思路
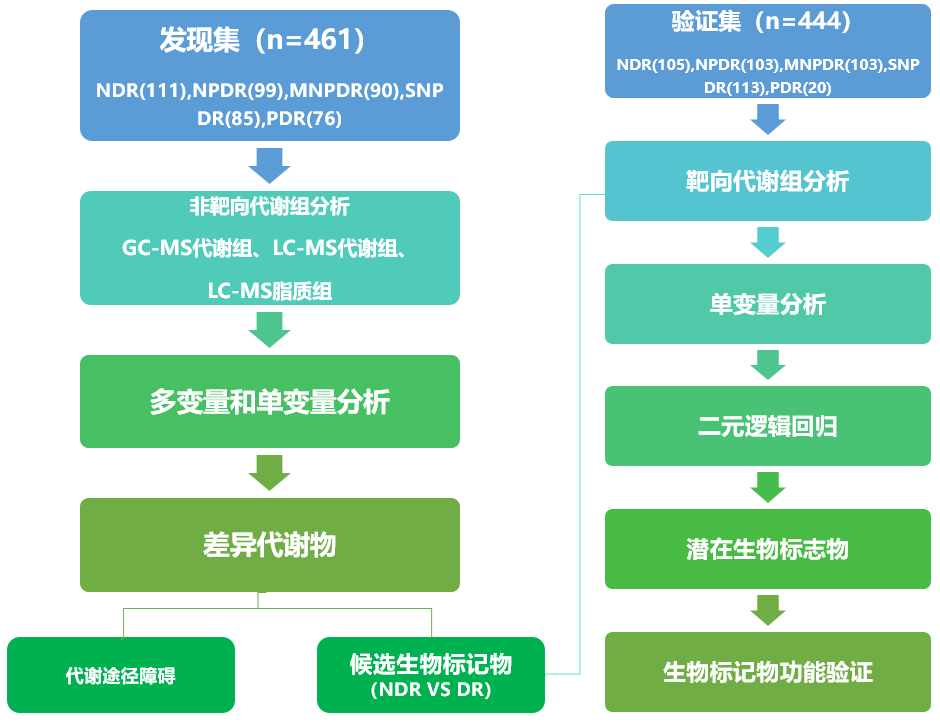
结果与讨论
1、DR代谢及脂质化合物谱图分析
首先,生成偏最小二乘判别分析(PLS-DA)得分图,并且置换测试表明模型可靠且无过度拟合(图1A、B和C)。DR受试者与NDR受试者的明显分离意味着DR中发生了异常代谢,随后针对DR和NDR组之间三个平台鉴定出的代谢物进行了单变量分析。共有348种独特代谢物(分别来自GC-MSM,LC-MSM和LC-MSL的93种,119种和194种代谢物)符合p <0.05和FDR<0.05的标准,显示出DR和NDR组之间的显著性变化(图1D)。另外,与NDR受试者相比,DR中多种脂质(亚)类(例如,脂肪酸,磷脂和鞘脂)显著增加(图1E)。
2、NPDR代谢及脂质化合物谱图分析
早期DR的检测对于治疗非常重要。因此,招募了早期DR的样本,即NPDR,以研究代谢组学和脂质组学分布。根据来自GC-MSM(图1H),LC-MSM(图1I)和LC-MSL(图1J)的代谢组学数据,PLS-DA分析表明,NPDR组也明显与NDR组分离。另外,来自GCMSM,LC-MSM和LC-MSL平台的总共81、103和156种代谢物在NPDR和NDR组之间存在显著差异(p <0.05,FDR <0.05,图1K)。此外,相对于NDR,NPDR中多种脂质(亚)类(例如,脂肪酸,磷脂和鞘脂)的总水平显示出显著增加(图1L)。
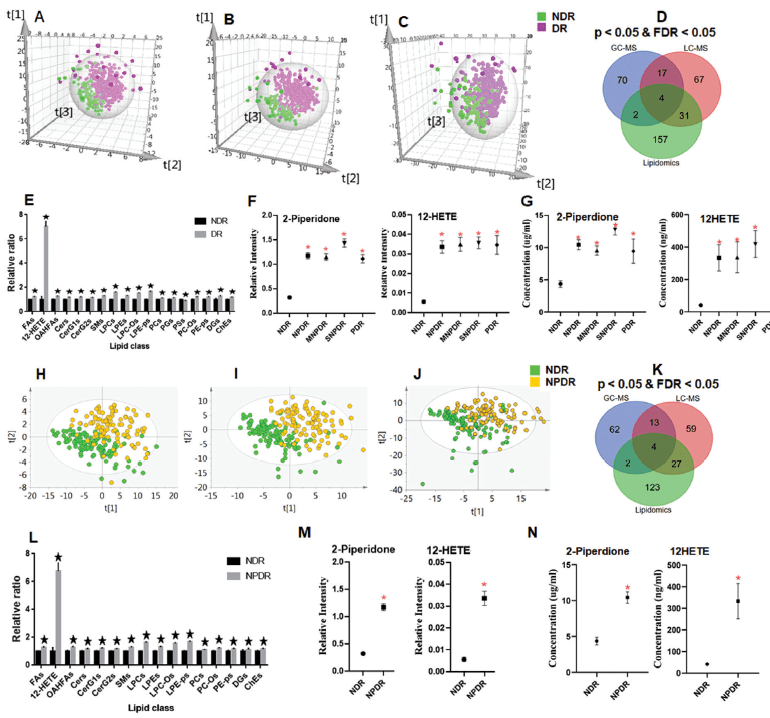
图1 | DR和NDR样本代谢物整体分布情况
3、不同临床亚型的DR患者的代谢及脂质化合物分析
在discovery阶段,鉴定了NDR,NPDR,MNPDR,SNPDR和PDR不同临床级别之间的差异代谢物。与NDR组相比,PDR和非PDR(包括NPDR,MNPDR和SNPDR)中的大量代谢物显著变化。与非PDR组相比,PDR组中的某些代谢物表现出明显的变化。但是,很少有代谢物在NPDR,MNPDR和SNPDR之间的成对比较中显示出显著变化。此外,还观察到PDR组趋向于接近NDR,这意味着PDR组与其它组(例如NPDR,MNPDR和SNPDR)相比,具有与NDR组更相似的代谢分子特征。
4、差异代谢通路分析
为了系统地评估DR的代谢紊乱机理,对代谢组学数据进行了代谢通路分析。DR引起的代谢紊乱主要与糖酵解代谢,TCA代谢,尿素循环代谢,多元醇代谢,氨基酸代谢(例如,甘氨酸,丝氨酸和苏氨酸代谢;牛磺酸和次牛磺酸代谢;精氨酸-脯氨酸代谢;缬氨酸-亮氨酸–异亮氨酸的生物合成)和脂质代谢(例如,磷脂代谢,鞘脂代谢,甘油酯代谢和脂肪酸代谢)有关。
5、发现集中DR的代谢物标记和诊断性能分析
在discovery研究中,DR受试者中12-HETE和2-piperidone(2-哌啶酮)的水平比NDR受试者高得多(图1F)。基于12-HETE和2-哌啶酮对DR和NDR组进行了二元逻辑回归分析,新型组合标志物(2-哌啶酮和12 HETE)(AUC 0.946)的诊断性能在区分DR和NDR方面优于12-HETE(AUC 0.924),2-哌啶酮(AUC 0.882)和HbA1c(AUC 0.691)。此外,新型组合标志物(0.894和0.919)显示出比HbA1c(0.657和0.686)更高的敏感性和特异性。
还观察到,NPDR组的12-HETE和2-哌啶酮水平高于NDR组(图1M)。在区分NPDR和NDR方面,新型组合标志物(AUC 0.958)的诊断性能优于12-HETE(AUC 0.923),2-哌啶酮(AUC 0.893)和HbA1c(AUC 0.648)。此外,在区分NPDR和NDR方面,新型组合标志物显示出比HbA1c(0.611和0.686)更高的敏感性和特异性(0.929和0.901)。这些结果突出了新型组合标志物早期诊断潜力。
6、验证集中DR的代谢物标记和诊断性能分析
为了验证新型组合标志物在区分DR或早期DR与NDR方面的诊断性能,进一步研究了444个样本(包括105个NDR,103个NPDR,103个MNPDR,113个SNPDR和20个PDR样本)的另一个独立队列(验证集)。基于LC-MS平台,以MRM对12-HETE和2-哌啶酮进行了定量。
在验证集中,DR和早期DR的血清12-HETE和2-哌啶酮的浓度要比NDR高得多(图1G,N)。这些化合物通过用于DR和NPDR检测的逻辑回归模型用于构建生物标志物组。与发现结果相似,新型组合标志物在区分DR和NPDR与NDR方面表现出比HBA1c更高的诊断性能。在DR和NDR比较组中的相应参数分别为(AUC 0.928,敏感性0.805和特异性0.933)与(AUC 0.555,敏感性0.392和特异性0.760),在NPDR与NDR比较组中的相应参数分别为(AUC 0.925,敏感性0.816和特异性0.933)与(AUC 0.518,敏感性0.327和特异性0.760)。从以上数据可以看出,尽管HbA1c是唯一经过验证的DR进展的全身生物标志物,但是它不足以将DR与NDR区分开,相反,本研究新定义的组合标志物可以实现更好的诊断潜能适用于发现组和验证组。
7、代谢组学和脂质组学途径分析
代谢组学提供了对疾病途径的独特见解,因为代谢产物是所有生物过程的产物,它们的差异水平反映了环境和遗传因素之间错综复杂的相互作用。本研究使用多种分析平台(GC-MSM,LC-MSM和LC-MSL)(以涵盖尽可能多的代谢物)对个体与DR相关的血清代谢物谱变化进行了系统评估。在所描述的348种独特代谢产物中,发现与DR发病相关的代谢产物比其他研究多得多,涉及与TCA和尿素循环代谢有关的代谢产物,(支链)氨基酸,多元醇,核苷酸及其衍生物,肉碱,胆汁酸和脂质等。此外,使用差异代谢物进行了完整的代谢途径分析,以探索基于途径的代谢组学特征,这些特征主要与能量代谢,氨基酸代谢和脂质代谢相关(图2)。
能量代谢在DR的发生和发展中起关键作用。糖酵解和TCA循环这两个主要的能量代谢途径,引起了作者的注意。研究发现与葡萄糖代谢相关的乳酸在DR患者中显示出明显的增加(图2A)。此外,与NDR相比,DR中柠檬酸,异柠檬酸,琥珀酸,富马酸和苹果酸的水平也显著增加(图2A),反映了TCA系统增加的可能性。许多研究表明线粒体功能障碍与糖尿病及其并发症密切相关。研究观察到,相对于NDR,DR的TCA途径中右侧(富马酸和苹果酸)代谢物的倍数变化小于左侧(柠檬酸,异柠檬酸和琥珀酸)的倍数变化。作者假设右侧的中间体用于增强尿素循环,而左侧的中间体则通过天冬氨酸代谢得到补充。DR中的天冬氨酸代谢和尿素循环的增加似乎证实了上述假设。但是,详细的机制有待进一步研究。总体而言,能量代谢增加与DR的发作和进展有关。
研究发现,与NDR相比,DR中大多数氨基酸的含量均显著增加(图2A)。DR中高水平的精氨酸,鸟氨酸,瓜氨酸和脯氨酸反映了精氨酸代谢的上调。与许多其他研究一致,精氨酸代谢的增加可能是DR的介体,支链氨基酸(BCAA)代谢中亮氨酸,异亮氨酸和缬氨酸的水平也增加了。循环中BCAA的水平升高被认为与视网膜中谷氨酸的强烈神经毒性有关,这在DR神经变性中起重要作用。从根本上讲,BCAA通过激活mTOR途径发挥作用,该靶标在细胞生长,增殖和存活的调节以及VEGF途径的上调中起作用。VEGF途径的激活导致Caspase-3表达增加,从而导致视网膜损伤。因此,研究认为应更多地注意循环中氨基酸的水平,这将有助于理解DR的发病机理。
此外,相对于NDR,大多数脂质的水平显示DR的显著增加。鞘脂是脂质的必需成分之一。最近研究表明,神经酰胺,鞘氨醇和1鞘氨醇磷酸(S1P)已被确定为具有生物活性的鞘脂,S1P影响血管的形成,分化和内皮细胞迁移。因此,源自磷脂酰胆碱和鞘脂生物合成增加的高水平鞘脂(图2B)可能会加剧细胞增殖和血管形成,在DR发病和进展中起着非常重要的作用。

图2 | DR中代谢途径的变化
8、生物标志物确认和验证
在利用单变量分析进行系统筛选之后,鉴定并验证了包括2-哌啶酮和12 HETE的新型组合标志物。在这项研究中,还对NPDR患者的血清代谢物检测结果进行了早期诊断。该新型组合标志物在从高危人群(NDR)中分离出DR和早期DR(NPDR)方面表现良好。在发现组和验证组中,此新型组合标志物对DR的诊断准确性范围分别为75.0–92.9%和80.6 -95.0%。
12-HETE是类二十烷酸,是人类12-脂氧合酶(LOX)的主要产物,可在hRECs中诱导内质网(ER)应激。许多研究表明,类二十烷酸代谢紊乱在疾病进展中起着至关重要的作用。本研究发现DR中循环的12-HETE水平逐渐升高,并且与DR的发作和发展呈正相关。许多研究表明12-LOX通过激活ER应激,NADPH氧化酶和VEGFR2信号网络参与DR中的视网膜微血管失调,并且破坏Ca2 +稳态可能是促进信号通路的必要步骤。
另一种生物标记物2-哌啶酮,是一种在工业上广泛用于合成聚合物(尼龙5)的单体。然而,迄今为止尚无血清中2-哌啶酮的报道。在本研究中,DR和早期DR中的循环2-哌啶酮水平显著增加。然而,目前无法通过细胞生物学研究发现2-哌啶酮的相关途径或生物学功能。因此,作者研究了hRECs中2-哌啶酮的生物学功能,以确定2-哌啶酮是否具有与DR进展相关的生物学功能。
与对照组相比,添加2-哌啶酮的hRECs(浓度≥0.4μg mL−1)在24和72 h时存活率显著提高。超过0.4μgmL-1的2-哌啶酮可促进hREC增殖。与对照组相比,用各种浓度(0.75、1.5、3μgmL-1)的2-哌啶酮处理的hRECs中VEGFA和VEGFR2的相对mRNA表达水平明显增加。此外,用2-哌啶酮处理的hRECs培养基中VEGF的相对浓度显著升高。用2-哌啶酮处理的hRECs中VEGFR2的表达也显着增加。重要的是,在用2-哌啶酮处理的hREC中观察到明显的血管形成。这些结果似乎暗示2-哌啶酮能够促进血管生成。与对照相比,浓度分别为0.75、1.5和3μgmL-1的2-哌啶酮处理的hRECs中,相关基因(例如TNF-α,IL-6,ICAM1和VCAM1)的相对mRNA表达水平显著增加。根据ICAM1和VCAM1的免疫印迹以及IL-6和TNF-α的相对浓度,在用2-哌啶酮处理的hREC中,观察到明显的上调,表明2-哌啶酮与促炎活性密切相关。结果表明,一种新的生物标记物2-哌啶酮,独立于12-HETE,可以促进hREC增殖,血管生成和炎症,而这些指标与DR的发展密切相关。
实验结论
综上所述,本研究突显了代谢组学研究对于确定DR发病机理的潜在重要性,表明代谢组学分析可有效识别高危人群的DR和早期DR的诊断标记。生物标志物(2-哌啶酮)具有促进hREC增殖,血管生成和炎症的生物学功能。到目前为止,这是最全面的代谢组学研究,涉及大量人群,研究代谢谱与DR发作和进展之间的关系。这项基于多平台的代谢组学研究为全面探索复杂的代谢网络并用于DR血清生物标志物筛查提供了实用的研究策略。
作者推荐
本研究对严重危害人类健康的糖尿病性视网膜病变展开研究,共纳入905名受试者的血清样本,基于多平台代谢组学数据,全面地揭示了糖尿病视网膜病变发生发展过程中异常的代谢特征和紊乱的代谢通路。通过多变量/单变量统计分析,研究人员发现并验证了一个新型组合标志物(12-HETE和2-piperidone),实现了糖尿病视网膜病变的快速、精准的体外诊断。这项基于多平台的代谢组学研究为全面探索复杂的代谢网络并用于DR血清生物标志物筛查提供了实用的研究策略。
转载自:鹿明生物
- 本文固定链接: https://maimengkong.com/zu/1707.html
- 转载请注明: : 萌小白 2024年3月30日 于 卖萌控的博客 发表
- 百度已收录
