想验证miRNA和靶基因的靶向互作?想知道转录因子与启动子的调控机制?想研究启动子的结构?想分析转录因子的转录激活……这些统统可以用双荧光素酶报告基因检测实验来实现,是不是很强大!那么如此强大的实验你了解多少呢?这么多的应用你会不会一脸懵呢?双荧光素酶报告基因到底是个啥“玩意儿”可以进行做这么多的实验?这些问题想要找到答案就跟着小远的文章往下看吧!
原理简介
荧光素酶(Luciferase)是生物体内催化荧光素(luciferin)或脂肪醛(firefly aldehyde)氧化发光的一类酶的总称,来自于自然界能够发光的生物。自然界存在的荧光素酶来自萤火虫、发光细菌、发光海星、发光节虫、发光鱼、发光甲虫等。目前,以北美萤火虫(Photinus pyralis)来源的荧光素酶基因应用的最为广泛。该基因可编码550个氨基酸的荧光素酶蛋白,是一个62kDa的单体酶,无需表达后修饰,直接具有可被检测的酶活(张菊梅等, 2001)。另外,提取自海洋腔肠动物海肾的荧光素酶也是一种可以催化荧光素发生荧光反应的单亚基特异活性蛋白,其分子量为36kDa。同萤火虫荧光素酶一样,该蛋白质在完成转录翻译后即具有催化活性(赵斯斯, 2012)。
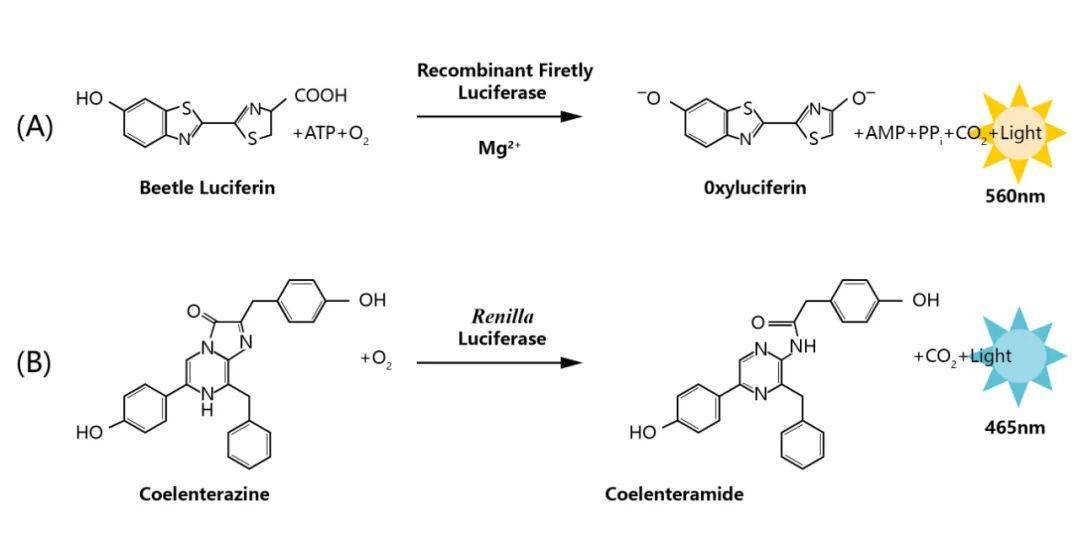
图1 荧光素酶发光原理(赵斯斯, 2012)。(A)萤火虫荧光素酶催化反应原理;(B)海肾荧光素酶催化反应原理。
利用荧光素酶与底物结合发生化学发光反应的特性,把感兴趣的基因的转录调控元件克隆在萤火虫荧光素酶基因的上/下游,构建成荧光素酶报告质粒。然后转染细胞,经适当刺激或处理后裂解细胞,测定荧光素酶活性。通过荧光素酶活性的高低判断刺激前后或不同刺激对感兴趣的调控元件的影响。
单荧光素酶检测系统只有萤火虫荧光素酶,该实验往往会受到各种实验条件的影响。而双荧光素酶报告基因检测系统在原有的基础上引入了海肾荧光素酶基因作为内参基因,将两个报告基因构建到同一个质粒上,分别用不同的启动子启动其表达。这样就可以减少内在变化因素对实验准确性的影响,相当于做了标准化,使测试结果不受实验条件变化的干扰。计算结果时,将萤火虫荧光素酶的检测值除以海肾荧光素酶检测值即可。
实验流程
双荧光素酶报告基因检测的实验步骤可大致概括为以下5步:
(1)构建相应的载体;
(2)将载体转化/染至烟草叶片、原生质体或动物细胞内进行表达;
(3)用裂解液裂解细胞;
(4)荧光检测;
(5)将检测数据进行分析得到实验结论。
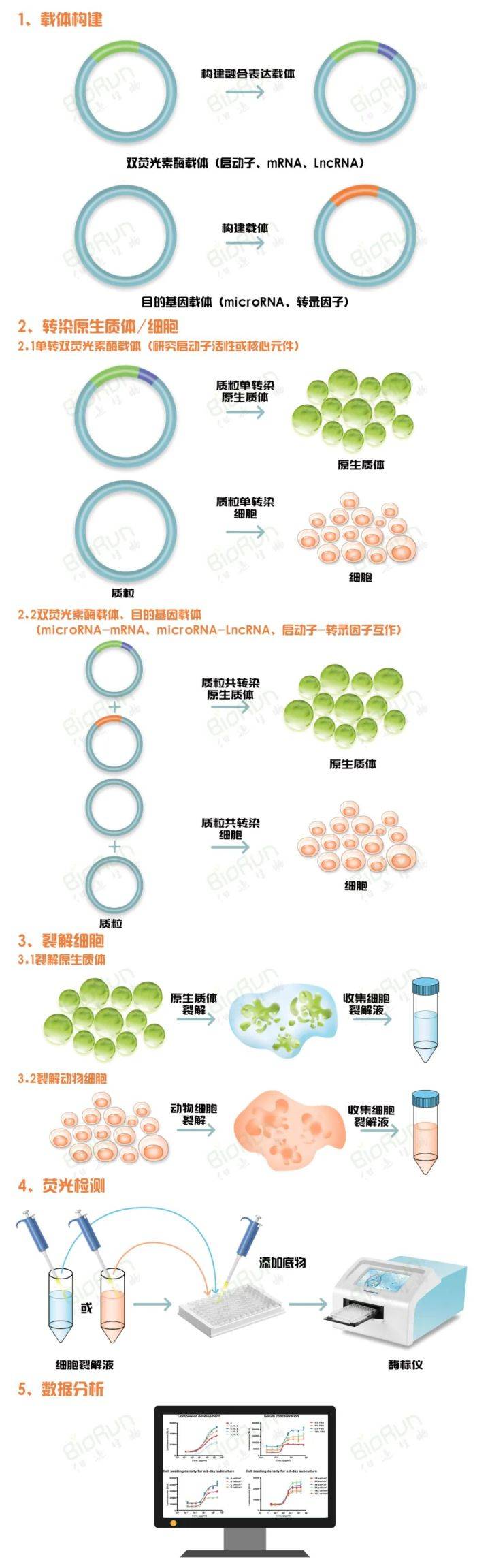
图2 双荧光素酶报告基因检测实验流程。图片来源:伯远生物科研绘图团队。
除了上述的实验流程外,双荧光素酶报告基因检测实验还可以按照如下实验流程进行:
(1)构建相应的载体;
(2)转化农杆菌并注射烟草;
(3)注射后的烟草进行培养;
(4)剪下注射过农杆菌的烟草叶片,在仪器中进行拍摄观察荧光结果。

图3 双荧光素酶报告基因拍照实验流程。图片来源:伯远生物科研绘图团队。
应用方向
(1)miRNA与靶基因的靶向互作研究
MicroRNA(miRNA)是一类内生的、长度约20-24个核苷酸的小RNA。一个miRNA可以靶向不同基因进行调节,同时同一个基因也可以被好几个miRNAs靶向。MiRNA可以与编码基因mRNA的3’UTR结合也可以直接与circRNA或lncRNA结合来调控相关基因的表达。
将待测mRNA的3’UTR序列插入报告基因载体,再共转入对应的miRNA,如果荧光素酶活性下降,则提示为其靶序列。同样的原理也可验证miRNA同lncRNA之间的靶向互作。

图4 我司验证miRNA与mRNA靶向互作时的载体构建原理图。图片来源:伯远生物科研绘图团队。
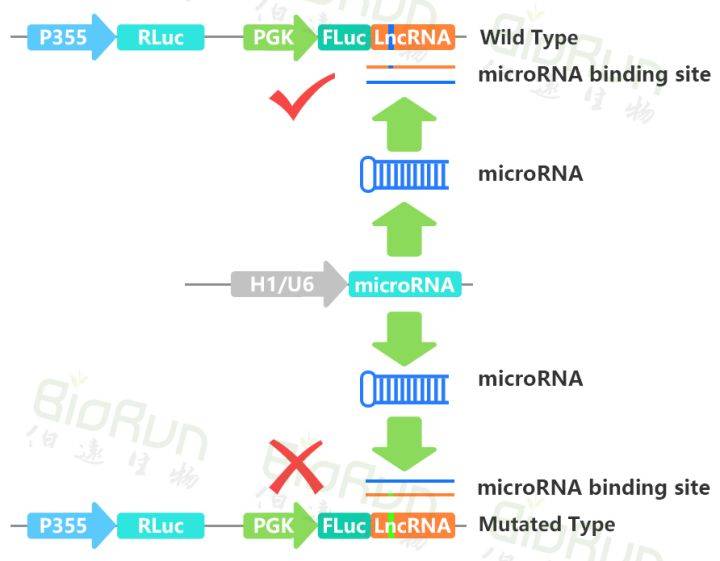
图5 我司验证miRNA与lncRNA靶向互作时的载体构建原理图。图片来源:伯远生物科研绘图团队。
文献举例:
2021年12月10日,Jia等人在Molecular Cancer杂志上发表了题为“Long non-coding RNA NORAD/miR-224-3p/MTDH axis contributes to CDDP resistance of esophageal squamous cell carcinoma by promoting nuclear accumulation of β-catenin.”的研究论文,在该文中作者首先通过分析公共数据库确认了lncRNA—NORAD可能与耐药性的食管鳞状细胞癌(ESCC)密切相关。接着结合FISH、双荧光素酶报告基因检测实验、细胞功能分析等最终确定了肿瘤细胞可以通过NORAD/miR-224-3p/MTDH途径,调控细胞对抗癌药物的耐受作用。
为了探索ESCC中与CDDP(Cisplatin:顺氯氨铂)抗性有关的miRNA,作者结合在线数据库预测到miR-224-3p具有与NORAD结合的潜力(图6A)。通过敲低KYSE30/CDDP-R和TE1/CDDP-R细胞中的NORAD,miR-224-3p的表达会显著增加(图6B)。此外,FISH实验也显示miR-224-3p与NORAD存在共定位。为了验证miRNA与NORAD的结合作用,作者通过双荧光素酶报告基因检测实验进行了验证。结果表明,荧光素酶的活性在WT组和MUT #2组显著下降,而在MUT #1组没有改变,证明NORAD通过#1位点与miR-224-3p结合(图6C)。
随后作者通过数据库查找到miR-224-3p可能潜在靶向MTDH的3’-UTR,结合双荧光素酶报告基因检测实验最终得到了确认(图7)。在ESCC细胞中过表达miR-224-3p可以降低MTDH表达,表明miR-224-3p可以通过结合3’-UTR调控MTDH的表达。为了确定NORAD是否通过miR-224-3p来上调MTDH,作者用shRNA敲低了NORAD,结果显示MTDH的表达显著下调,而在敲低NORAD的同时干扰miR-224-3p,又可以使MTDH表达恢复。这些结果均证实了NORAD/miR-224-3p/MTDH途径的存在。

图6 验证miRNA与NORAD的结合作用(Jia et al., 2021)。(A)预测的NORAD上与miR-224-3p的结合位点;(B)sh-NORAD对ESCC细胞中miR-224-3p、miR-28-5p和miR-7-5p表达的影响,标准化为U6表达;(C)KYSE30/CDDP-R和TE1/CDDP-R细胞中的荧光素酶活性检测结果。

图7 MTDH是miR-224-3p的直接靶标(Jia et al., 2021)。(A)MTDH的3'-UTR上预测的与miR-224-3p的结合位点以及相应的突变序列;(B)KYSE30/CDDP-R细胞中的荧光素酶活性检测结果。
小结:在本文中作者先后采用双荧光素酶报告基因检测实验,证实了miRNA与lncRNA的靶向互作以及miRNA与mRNA的靶向互作,并最终解析出了NORAD/miR-224-3p/MTDH途径,通篇阅读下来可以看出双荧光素酶报告基因检测实验在本文中起了很大的作用,当然最终结论的得出也离不了其他实验方法的协同作用。总之,在研究过程中大家一定要用多种研究方法相互印证实验结果这样才能得到准确的结论哦。
(2)转录因子与启动子调控机制研究
转录因子(Transcription factor,TF)也称为反式作用因子,是指能够与真核基因的顺式作用元件发生特异性相互作用,并对基因的转录有激活或抑制作用的DNA结合蛋白。一些转录因子仅与其靶基因启动子中的特异序列结合,这些特异性的序列被称为顺式作用元件,转录因子的DNA结合域和顺式作用元件实现共价结合,从而对基因的表达起抑制或增强的作用。双荧光素酶报告基因实验是检测这类转录因子和其靶基因启动子中的特异顺式元件结合的重要手段。
将启动子区域插入双荧光素酶报告基因载体,同时在实验细胞中共转过表达对应的转录因子,可分析转录因子过表达是否提高或降低荧光素酶活性。

图8 我司验证特定转录因子与启动子互作时的载体构建原理图。图片来源:伯远生物科研绘图团队。
文献举例:
2022年3月15日,Liu等人在New Phytologist上发表了题为“Kiwifruit MYBS1-like and GBF3 transcription factors influence L-ascorbic acid biosynthesis by activating transcription of GDP-L-galactose phosphorylase 3.”的研究论文。该研究鉴定了猕猴桃维生素C(L-抗坏血酸,AsA)合成的关键基因AceGGP3,揭示了1R-MYB类型转录因子AceMYBS1和bZIP家族AceGBF3转录因子协同调控AceGGP3基因,促进猕猴桃维生素C合成的新机制。
作者首先通过RNA表达谱分析、瞬时转化、转基因和基因编辑等试验,挖掘了毛花猕猴桃维生素C合成的关键基因AceGGP3,该基因的上调或下调表达对猕猴桃中维生素C的积累有很大影响。 接着,他们利用转录组分析和荧光定量PCR等实验,鉴定出一个1R-MYB类型的转录因子AceMYBS1。为了揭示AceGGP3受AceMYBS1调控的机制,作者利用酵母单杂交,双荧光素酶报告基因检测和EMSA等实验共同揭示了AceMYBS1可直接结合到AceGGP3的启动子上,激活AceGGP3基因的转录(图9)。最后,为了进一步研究AceMYBS1的功能,作者通过Y2H筛选到了AceMYBS1的互作蛋白AceGBF3,结合BiFC、荧光素酶互补、pull-down等实验,证实了AceMYBS1与AceGBF3在体内外可以相互作用,通过双荧光素酶报告基因检测、过表达和病毒诱导的基因沉默实验表明,AceMYBS1与AceGBF3相互结合能够诱导AceGGP3的表达,形成一个AceGBF3-AceMYBS1-AceGGP3调控网络(图10),协同促进猕猴桃中维生素C的合成。
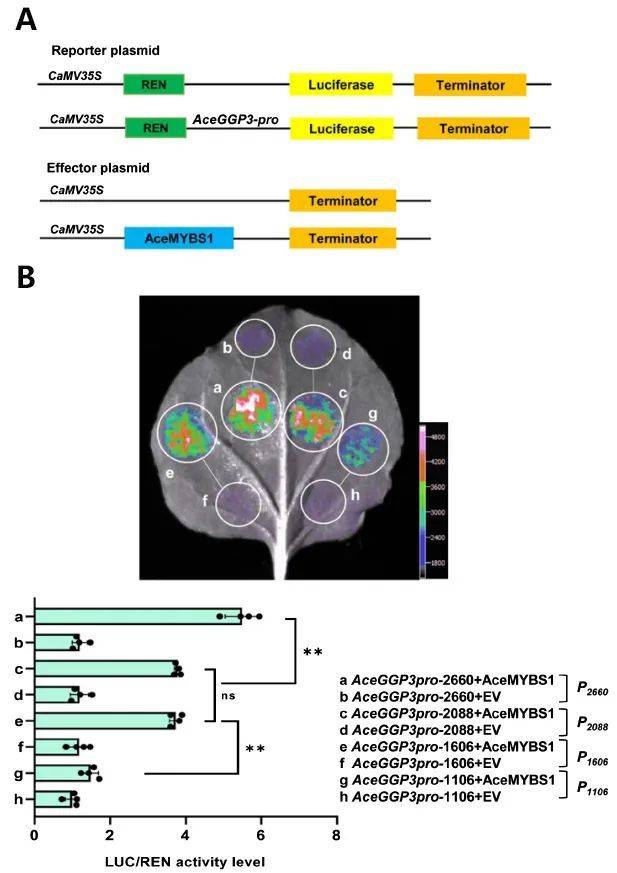
图9 AceGGP3的启动子是AceMYBS1的直接靶标(Liu et al., 2022)。(A)载体构建示意图。将AceGGP3的启动子片段克隆到pGreenII0800-LUC载体中以生成报告构建体。通过将AceMYBS1基因重组到过表达载体POE-3×Flag-DN中产生效应因子。(B)本氏烟草叶片中的双荧光素酶测定显示AceMYBS1激活AceGGP3启动子。

图10 本氏烟草叶中的双荧光素酶(LUC)测定显示AceGGP3的转录被AceMYBS1单独激活或被AceMYBS1和AceGBF3共同激活(Liu et al., 2022)。
小结:在这个文献案例中,大家可以看到作者在研究转录因子与启动子的调控机制时是利用酵母单杂交,双荧光素酶报告基因检测和EMSA等实验共同验证得出的结论,这也再一次提示我们在研究过程中一定要学会用多种方法相互验证之后才能得出最终的结论哦!
(3)启动子结构分析
启动子是基因的重要组成部分,其主要功能为调控基因表达(转录)的起始时间和表达程度。对启动子的分析重点集中于对启动子中各调控元件,即各种转录因子的DNA识别/结合位点,这些元件通常较为保守,长度较短,从几个碱基到十几个碱基不等。
将启动子区域序列(通常2k左右)进行分段截短,或对特定位点进行突变,再分别构建入双荧光素酶报告载体,检测其启动子活性,进而确定启动子中的核心元件。
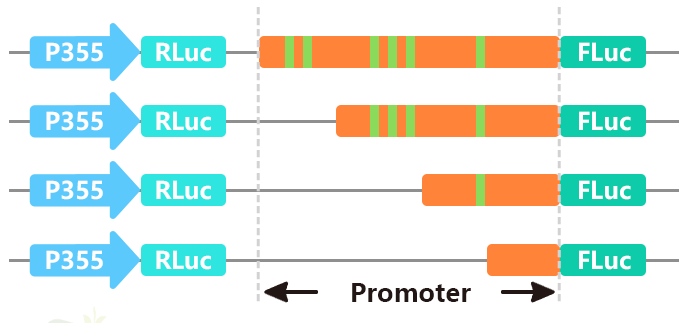
图11 我司分析启动子结构时的载体构建原理图。图片来源:伯远生物科研绘图团队。
文献举例:
2020年11月27日,Zhao等人在Plant Biotechnology Journal上在线发表了题为“Three AP2/ERF family members modulate flavonoid synthesis by regulating type IV chalcone isomerase in citrus.”的研究论文。在该研究中,作者通过双荧光素酶确定了AP2/ERF家族转录因子CitERF32、CitERF33和CitRAV1能够激活CitCHIL1启动子。为了确定CitERF32、CitERF33和CitRAV1与CitCHIL1启动子结合的核心元件,作者用PlantTFDB软件预测了CitERF32和CitERF33可能与CitCHIL1启动子中的GCCACCTTC基序(标记为P1)或CGCCGC基序(标记为P2)结合,此外,根据PlantTFDB的预测结果显示CitCHIL1启动子序列有两个相邻的CAACA结合位点(AP2结构域特异性结合基序gCaACA(g/t)(g/t)),标记为P3。用截短的启动子进行双荧光素酶报告基因检测实验的结果表明,三个转录因子只与位于启动子-500到-200bp之间的元件结合(图12)。
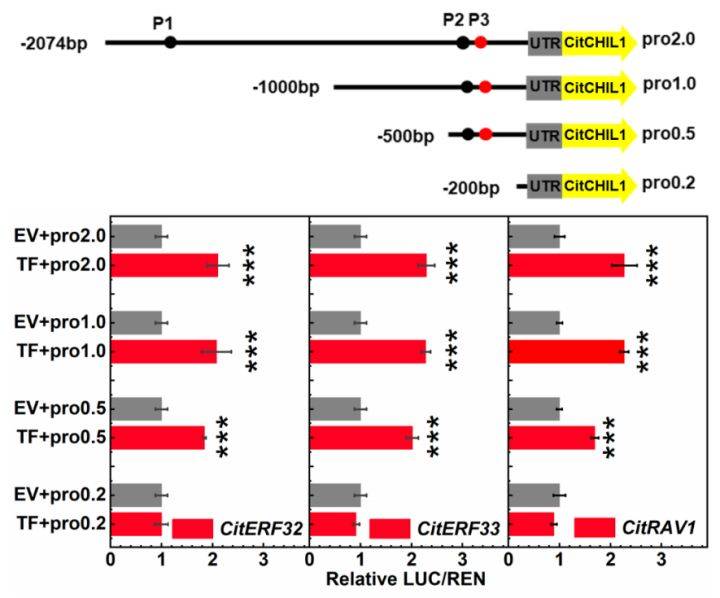
图12 用双荧光素酶测定截短后的CitCHIL1启动子活性的示意图及结果(Zhao et al., 2021)。启动子被分别截短为1000bp(pro1.0)、500bp(pro0.5)和200bp(pro0.2)。
小结:在对启动子结构进行分析之前,大家可以像作者一样先通过一些软件来对启动子的核心元件进行预测,然后结合自己的研究目的进行选择,并在此基础上对启动子进行截短分析,这样可以做到事半功倍哦!
(4)转录因子激活分析
想要验证一个基因是转录因子,可以从两个方面入手,其一是亚细胞定位分析,其二是转录激活分析。在进行转录激活分析时可按照下图将GAL-TATA插入报告基因载体,同时将转录因子连入BD载体与报告基因载体进行共转,结合荧光素酶的检测结果来分析转录因子是否有转录激活能力。
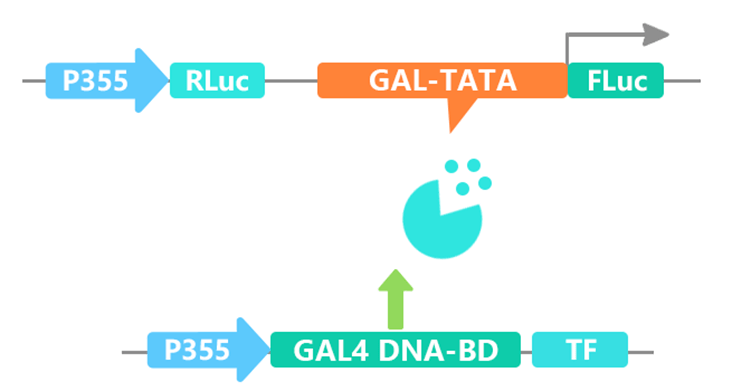
图13 我司分析转录因子转录激活时的载体构建原理图。图片来源:伯远生物科研绘图团队。
文献举例:
2022年1月13日,Yang等人在Horticulture Research上发表了题为“DgMYB2 improves cold resistance in chrysanthemum by directly targeting DgGPX1”的研究论文。在该文中,作者首先通过转录组分析发现了在冷处理条件下,菊花中的DgMYB2被显著诱导,因此选择该基因用于进一步的研究。DgMYB2的氨基酸序列含有一个SANT/MYB保守结构域,表明DgMYB2是一个典型的R1-MYB转录因子,其序列与多种植物中的其他R1-MYB转录因子序列高度同源。作者结合亚细胞定位的结果,确认了DgMYB2定位于细胞核内。为了进一步分析DgMYB2的转录激活活性,作者使用双荧光素酶报告基因检测实验来进行研究。结果显示,报告基因载体和pBD-DgMYB2共注射的实验组的LUC/REN值显著高于阴性对照(pBD-Empty)(图14),表明DgMYB2具有转录激活活性。

图14 DgMYB2定位于细胞核中并具有转录激活活性( et al., 2022)。(a)DgMYB2在烟草叶片中的亚细胞定位。(b)DgMYB2烟草中的转录激活。
小结:转录激活分析是确定确认基因是否为转录因子必不可少的实验。而除了上述的双荧光素酶报告基因检测实验外,酵母实验系统也常被用做检测转录因子的转录激活活性。两者的差别在于前者是以荧光素酶活性来衡量,而后者是以β-半乳糖苷酶的活性来衡量,在研究过程中具体使用什么方法可以自己选择哦!另外,全长转录因子如果没有转录激活活性,其原因可能是转录因子内部存在转录抑制结构域,大家遇到时可以去探究其具体的位置,这种案例小远在之前的推文中也有写过,感兴趣的小伙伴可以查阅小远的往期文章:最强大脑炼成记——如何验证一个基因是转录因子。
小远叨叨
文章至此就告一段落了,在本文中小远主要给大家介绍了双荧光素酶报告基因检测实验的四类常见应用,除此之外,该实验还有很多其它应用方向,感兴趣的小伙伴可以自己查阅相关资料,也欢迎大家和小远一起讨论!此外,有关双荧光素酶报告基因检测实验的常见问题及注意事项可以查看小远的往期文章哦:【干货】如何做双荧光素酶实验?
References:
Jia Y, Tian C, Wang H, et al. Long non-coding RNA NORAD/miR-224-3p/MTDH axis contributes to CDDP resistance of esophageal squamous cell carcinoma by promoting nuclear accumulation of β-catenin. Mol Cancer. 2021, 20(1): 162.
Liu X, Wu R, Bulley SM, et al. Kiwifruit MYBS1-like and GBF3 transcription factors influence l-ascorbic acid biosynthesis by activating transcription of GDP-L-galactose phosphorylase 3. New Phytol. 2022, 234(5): 1782-1800.
Yang X, Luo Y, Bai H, et al. DgMYB2 improves cold resistance in chrysanthemum by directly targeting DgGPX1. Hortic Res. 2022, 9: uhab028.
Zhao C, Liu X, Gong Q, et al. Three AP2/ERF family members modulate flavonoid synthesis by regulating type IV chalcone isomerase in citrus. Plant Biotechnol J. 2021, 19(4): 671-688.
赵斯斯. 家蚕P450基因CYP9A19和CYP9A22的启动子分析. 苏州: 苏州大学, 2012.
张菊梅, 吴清平, 周小燕, 等. 荧光素酶研究进展. 微生物学通报, 2001, 28(5): 98-101.
- 本文固定链接: https://maimengkong.com/kyjc/1439.html
- 转载请注明: : 萌小白 2023年4月15日 于 卖萌控的博客 发表
- 百度已收录
