
一、宿主决定因素
动物以多种方式塑造其微生物组,主要包括宿主遗传、免疫以及饮食等。
1.1 宿主遗传因素
动物塑造其微生物组的机制中有许多是在宿主的遗传水平上进行的。这类机制可以通过在基因上容易操作的模式生物中进行实验验证,也可以通过利用个体之间的自然变异进行大规模比较来揭示。研究人员利用近亲繁殖小鼠品系杂交,发现了与特定肠道微生物丰度与宿主单核苷酸多态性 (SNPs) 相关。例如,免疫调节Irak3 TLR2 (toll样受体2) 信号通路所需的基因变化塑造了乳球菌和科氏杆菌科的丰度,这可能是通过改变宿主对肽聚糖的免疫反应能力实现的。类似地,在生命早期表达toll样受体5 (Tlr5) 基因与小鼠的肠道菌群改变有关,而这则可能是通过增强对鞭毛细菌的免疫反应实现的。这些研究结果表明,广泛的先天免疫激活通过肠道菌群对宿主进行调控。有证据表明,这些影响至少部分是由微生物传播或环境因素造成的,因为当小鼠没有单独饲养时,野生型和tlr5缺陷小鼠之间原有的差异消失。
1.2 免疫
在适应性免疫反应中,模式识别和体液反应也会影响微生物的组成。免疫球蛋白A (IgA) 是识别肠道菌群的主要亚型。宿主分泌大量的与微生物结合的IgA到肠道腔内,这些IgA要么广泛地与低微生物亲和力反应,要么相对特异性地与高亲和力反应,并与多个细菌 (在某些情况下,是病毒) 家族中常见的基序结合。这使得一些研究人员将这种广泛的IgA反应视为一种先天免疫。这些广泛交叉反应的抗体在体内对细菌的反应性增强,表现出环境和宿主反应之间的协同作用。这种效应的产生可能是由于自然环境中微生物抗原的表达增加,或者是由于宿主环境的特异性因素而导致抗体抗原相互作用的改善,从而可能导致微生态系成员的生态位特异性支持。
在人类中,利用同卵和异卵双胞胎之间的遗传变异进行的双胞胎研究已经确定了宿主基因和肠道微生物群组成之间的联系。在对>1000对双胞胎的粪便菌群的研究中,包括Christensenellaceae和Turicibacteraceae在内的几个细菌类群与宿主遗传变异显著相关。将这些丰度测量结果与单核苷酸多态性进行比较,研究人员确定了几个潜在的具有形成微生物区系组成的遗传位点。乳糖酶基因的多态性与宿主乳糖酶活性的降低和能代谢乳糖的双歧杆菌的增多有关。类似这样的双胞胎研究还揭示了微生物群构成与味觉和嗅觉相关的基因之间的几种相关性,它们共同指向了宿主控制微生物群的另一途径,即饮食。
1.3 饮食
饮食可通过引入新物种和提供特定的营养物质来改变微生物群的组成和活性,通过营养过剩和饥饿来选择某些微生物的富集或消耗,同时改变微生物群成员的表达谱来降解动态的物质。在人类中,乳汁低聚糖是一种复杂的碳水化合物,婴儿无法消化。然而,这些低聚糖维持特定的成员的新生儿菌群,包括可促进粘膜免疫的特定的双歧杆菌,同时形成成熟的婴儿微生物组。
此外,还有一些例子表明饮食对微生物群的影响比宿主基因型的影响更大。多种小鼠研究表明,改变饮食中营养成分可以影响如免疫信号等宿主因素的影响。食物成分可以改变宿主和微生物组之间的相互作用,调节微生物对宿主提供的营养物质的依赖。例如,改变宿主黏液蛋白的岩藻糖基化可改变肠道菌群的组成和转录活性。只有当肠道菌群依赖黏液多糖作为营养来源时,这种效应才会显现,而当小鼠被喂食富含多种碳水化合物的食物时,这种效应会减弱,这表明饮食是肠道微生物组的主要调节因子。这些观察结果为通过饮食干预纠正微生物群失衡或缺陷提供了希望,可能是通过营养补充物来选择或对抗特定微生物(益生菌)。
通过对宿主基因型和微生物组组成的分类学谱系调查,有可能了解到进化史和微生物定植之间的潜在关系。Brooks等人描述了“系统发育共生关系”(phylosymbiosis)的概念,即宿主分类学与菌群结构的关系,表明这一概念适用于不同的动物类群。也就是说动物物种形成事件通常是由微生物组组成反映出来的,与宿主关系更近的个体拥有更多相似的微生物组。这种模式在物种内部和物种之间都适用,同一物种的成员比不同物种的成员表现出更多相似的肠道微生物组。
值得注意的是,这些共同进化的微生物组对宿主的健康有影响。例如,特定的细菌,如植物乳杆菌,在果蝇发育的不同阶段促进了多种适应性表型。在这种情况下,果蝇幼虫被植物乳杆菌衍生挥发物吸引,促进植物乳杆菌在其食物上繁殖,增加细菌丰度,促进果蝇幼虫生长。此外,植物乳杆菌必须反复摄入,它不能稳定地在肠道中定植,这表明外部来源的微生物群可能对宿主生理学有重要意义。特定的微生物组组成所带来的好处往往足以选择动物在进化的时间尺度上用来塑造其微生物组的机制。
二、受微生物组调控的新兴表型
2.1 调控发育
除了专性共生,动物和它们的进化上的亲缘关系成员的生命周期和活动需要依靠特定的微生物维持(图1)。在与动物最近的进化成员--领鞭虫类Salpingoeca rosetta,从单细胞到多细胞的过渡是由自然共生细菌Algoriphagus machipongonensis产生的一系列脂类调控的。该细菌伙伴产生至少两种磺胺类脂质,刺激S. rosetta中多细胞莲座丛的形成,同时还产生至少两种溶血磷脂酰乙醇胺,促进多细胞玫瑰环的稳定性,以及一种抑制玫瑰环形成的capnine脂质。S. rosetta多细胞性被预测会降低运动但会提高进食,所以A. machipongonensis不是构成性的细菌,细菌刺激玫瑰环形成可能通过为S. rosetta提供不同的生活方式策略而产生环境特异性的适应度结果(图1A)。因此,细菌的结合为宿主在环境变化时期的适应性和健康提供了优势。
2.2 调控防御
在某些情况下,这些相互发展的关系可以提供足够的互惠促进伙伴之间的共同进化。例如,夏威夷短尾乌贼Euprymna scolopes与生物性发光的gamma-proteobacterium fischeri之间的互惠关系在乌贼中一个特定进化的共生器官的界面上受到了严格的调控。虽然在实验室条件下,两种物种都可以单独饲养,并不会受到严重损害,但细菌通过反照明的生物荧光伪装为乌贼提供了一种独特的躲避捕食者的能力,而乌贼本身并没有进化出这种能力(图1B)。作为回报,乌贼为V. fischeri提供了一个其他细菌无法进入的特殊生态位和丰富的营养来促进细菌密度的提高。
2.3 调控进食及代谢
类似地,微生物群赋予的功能可以赋予宿主消耗其他难以处理的食物来源的能力,为宿主开辟新的生态可能性。在以木材为食的高等白蚁中,木碳水化合物的代谢能力是由中肠和后肠的细菌群协同活动促进的。白蚁利用主要由后肠密螺旋体细菌共生体提供的木聚糖降解的糖苷水解酶,使木材纤维素生物被其他微生物和宿主利用。通过系统发育分析,发现这些基因极有可能来源于厚壁菌门细菌。这些木聚糖酶通过细菌伙伴间的水平基因转移被重新引入,使得这些白蚁可以以木头为食物,类似于低等白蚁在真核共生的帮助下以木头为食物(图1C,上图)。
在人类微生物群中也发现了类似的由微生物群引导的代谢转变的可能性。肠道微生物plebeius与能够消化藻类碳水化合物被卟啉酶和没食子酶的基因富集。plebeius被认为是从降解海藻的相关海洋细菌中获得这些基因。对宏基因组数据集的分析表明,B. plebeius及其糖苷水解酶在来自日本的个体的肠道微生物组中富集,在那里海藻是饮食的常见组成部分。而这些酶在北美个体中含量较少,这表明环境获得和/或饮食维持了这种能力,并可能因微生物组组成而改变饮食 (图1C,底部) 。
2.4 调控免疫及健康
除了影响宿主的饮食能力和活动外,内源性微生物成员可以改变宿主的免疫状态,对宿主的健康有广泛的影响。例如,通过比较近亲繁殖小鼠的肠道微生物组,发现了与上皮相关的梭状芽胞杆菌-分叶丝状菌 (SFB) 的广泛影响。SFB会改变宿主的免疫反应,例如将辅助性T细胞极化为促炎/抗细胞外病原体状态 (由辅助性T -17细胞和白细胞介素-17促进) 从而保护小鼠细菌性感染。经SFB诱导的 T细胞也被发现在一些自身免疫性疾病和神经系统疾病的小鼠模型中是有害的。例如,在炎症性的自闭症谱系障碍小鼠模型中,定植带有SFB的橡皮障促进了后代的异常社会行为和机械重复。这些研究结果强调了微生物组对宿主生物学某些方面的潜在影响,这些方面曾被认为是独立于肠道生理的,如大脑发育和行为。
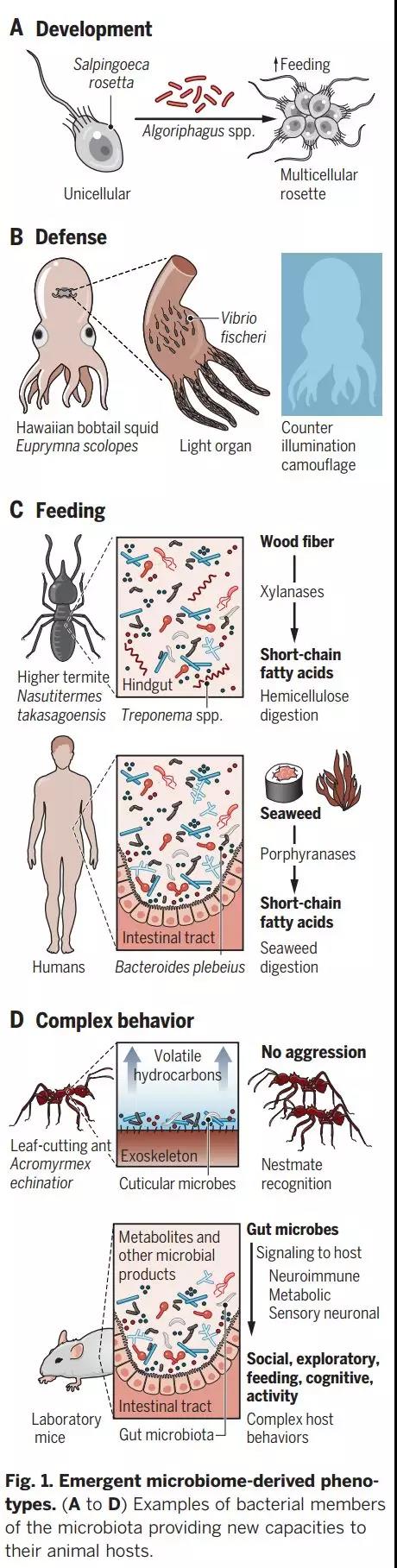
图1. 微生物来源的新兴表型
2.5 微生物对行为和神经表型的影响
微生物组状态和宿主行为之间的关联使我们对理解微生物组如何塑造宿主变得更为复杂。在许多生物中,可以通过微生物改变来解释很多大脑和行为表型。由于对研究设计,数据解释,以及动物行为与人类行为障碍的生理相关性的疑问,其中,有些研究结果是有争议的。有一些观察结果可以在在不同的模型生物内部和之间重复,而另外一些研究结果则为操纵微生物组可以改变动物行为和神经内表型疾病的概念提供了证据。
2.6 微生物对宿主行为的影响
有关微生物影响行为的最早案例涉及生物体之间的嗅觉交流。由微生物直接产生的挥发性化学物质可以形成宿主的气味特征,这是社交信号。例如,去除完全群居切叶蚁的微生物组可改变蚂蚁体中气味分子碳氢化合物的表达,并引发未处理过的巢穴伙伴的攻击行为(图1D,顶部)。来自同种蚂蚁体内的微生物群的再定植则会消除了这种效应,而来自不同蚁群的微生物的定植作用则会刺激巢穴同伴的攻击性行为。类似的现象已经被证明会影响黑腹果蝇的特定谱系中配偶的选择。
这种微生物组也能改变脊椎动物的气味特征。虽然微生物气味特征可以用来区分哺乳动物的年龄、性别和群体差异,但它们对社会行为的真正影响程度仍不清楚。灵长类动物和其他哺乳动物的情况尤其如此,它们的社会动机更为复杂,对嗅觉交流的依赖程度也较低。
2.7 微生物对宿主神经表型的影响
除了调节行为反应的化学信号外,微生物组对内源性神经生物学途径行为 (图1D,下图和图2) 的塑造能力也越来越受到重视。实验室内饲养的啮齿动物、苍蝇和斑马鱼,由于缺乏自然的微生物组,在传统的行为测定中表现出缺乏社交能力和社会偏好。类似于用来评估人类社交障碍,这些测试通常使用自动跟踪软件来量化动物与熟悉或不熟悉的同种动物互动的时间。据报道,在母体免疫系统受到挑战和母体高脂肪饮食的情况下,肠道菌群的变化会导致子代出现社会行为异常。而通过选择细菌进行产后治疗可以在自闭症的病因不同的遗传和环境老鼠模型中促进社交。虽然确切的机制尚不清楚,但有证据表明微生物改变或产生的生物化学物质可以改变大脑神经回路的活动进而调节社会机动。在微生物代谢物和它们的同源感受器,以及选择性激活和抑制神经元亚型的工具发展的推动下,使微生物与神经元之间的间接和直接信号传导研究成为可能。在某些情况下,微生物产生的分子,包括经典分子微生物相关分子模式和选择次级代谢产物,可以进入宿主组织和被神经元直接感知(图2)。其他情况下,微生物调节免疫系统或宿主核心代谢对宿主神经系统产生后续影响。总的来说,这些发现支持了微生物组可以改变宿主的生理结构,最终影响神经系统和行为的观点。除了社交相关的行为,许多对压力的反应,比如风险逃避和减少探索均与微生物组的改变有关。在不同的生物模型中开展的几项研究一致表明,微生物群的消耗或缺失可以减少应激行为,例如运动冻结和趋向性。例如,与普通对照相比,无菌小鼠和大鼠始终表现出更多的探索行为,主要表现在对进入一般认为不好的环境中所花费的时间或进入的数量。尽管这一行为现象背后的确切的机制尚未阐明。据推断可能是由循环应激激素 (如皮质酮) 水平的微生物依赖性变化和促肾上腺皮质激素下丘脑-垂体-肾上腺轴所调控的。
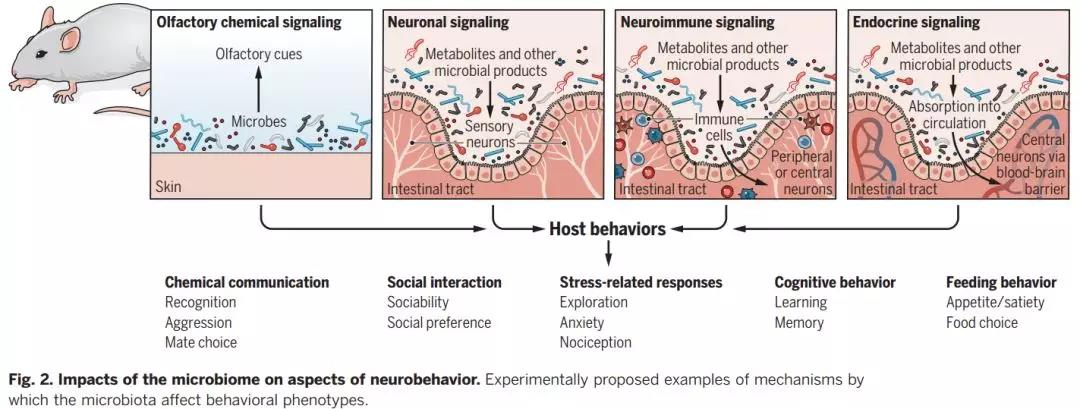
图2 微生物组对神经生物的影响
自从首次观察到以来,微生物来源的和微生物调节的激素、神经肽和神经递质数目逐渐增加。肠道微生物会调节数以百计的循环代谢物。有证据表明一些代谢物像对甲酚、4-乙基苯基硫酸盐和吲哚氧基硫酸盐一样,可以通过内分泌信号改变行为。据报道,这些小分子的前体穿过肠道上皮,在宿主组织中被修饰,进入体循环,并穿透血脑屏障。一些微生物的代谢物,如吲哚及其衍生物,可以直接激活迷走神经,而迷走神经包含了一组位于肠绒毛内的神经元,它们的接受域支配着脑干。产生吲哚的大肠杆菌的大鼠表现出更高的压力诱导静止,探索行为减少,迷走神经神经元的激活标志物表达增加。内分泌和感觉神经通路也被认为有助于肠道菌群对动物进食行为的影响。微生物代谢可调节循环营养和激素,如瘦素、胰岛素和胰高血糖素样肽1,它们影响饥饿和饱食的神经回路,迷走神经神经元检测周围能量状态,并将信息直接传递到下丘脑的内稳态中心。
随着越来越多的研究揭示了微生物组成员对动物行为的影响,出现了一个令人思索的关键问题,那就是人类微生物群的组成是否与人类行为障碍的症状有关。越来越多的报告表明,肠道菌群的改变与各种神经发育、神经精神病学和神经退行性疾病有关。然而,目前它们之间的因果关系尚不清楚,甚至在对具有相同诊断的个体进行的研究中,对于这些疾病是否具有明确的微生物特征也几乎没有共识。这可能是由于多种因素造成的,包括每种疾病内在的异质性、生活方式和医疗状况的差异、研究方法的差异、分析小样本数据的困难,或者仅仅是缺乏与疾病相关的特定微生物。
虽然微生物群在神经系统疾病发病机制中的作用仍存在争议,但有一些证据表明,基于微生物群的干预措施有助于减轻行为症状。例如,在一项对18名患有自闭症谱系障碍并伴有胃肠道紊乱的儿童的开放标签研究中,在粪便菌群移植后8周和2年后胃肠道和行为症状得到改善。微生物组与情绪相关的更有力证据来自随机双盲安慰剂对照研究,研究报告了益生菌(包括双歧杆菌和乳酸菌)对健康的人类志愿者、早产儿和慢性疲劳综合征患者的情绪困扰症状的积极作用。此外,越来越多的证据表明,宿主相关微生物与常见的神经化学物质和异种生物制剂相互作用,通过这些交互作用来改善宿主行为是非常令人振奋的。总之,这些发现为基于微生物学的干预措施影响情绪相关症状的美好前景提供了支持。此外,还有一种有趣的可能性,即沿着内脏-大脑轴的宿主条件可能是受微生物组刺激产生的紧急表型的产物。
三、宿主与其微生物组之间的伙伴关系
宿主和它们的微生物组通过共同进化来维持整体的稳态。为了回答我们之前提出的问题,可以说1)与宿主相关的微生物组的组成和功能活动不仅受到内部宿主因素的影响,也受到外部影响的影响。宿主的免疫反应、饮食和行为可以由动物的微生物组互相塑造。2)微生物组可以赋予宿主多种表型,包括代谢新颖性、捕食者防御和某些社会反应。3)微生物与神经生物学的相互作用可以改变动物的正常发育和行为,更加广泛地塑造动物健康所需的活动。随着越来越多的证据表明,微生物组可以改变复杂的行为,从进食和择偶到社交和风险规避,微生物行为的调节可能会影响宿主的进化适应性,但需要进一步的实验来直接验证这一点。
最后一点迫使我们不得不考虑几个新问题。现代的神经行为活动明显受到宿主相关微生物群的影响,它们是否也受微生物组的影响,类似于宿主依赖和相关的内共生生物的基因组退化?广义地说,宿主神经生物学的关键部分已经完全委托给了微生物,或者这些宿主生理学仅仅因为这些伙伴关系而出现?
如果微生物组负责正常的神经活动,在进化史上新物种的加入则可能使宿主物种有了行为和社会飞跃,而这一般会归因于大脑形态改变。在这种情况下,宿主和共生体共享这些进程的选择优势是什么?这些关系是真正的互惠关系,还是微生物群像寄生虫一样?还是宿主和微生物群的关系已经被现代环境改变了?尽管宿主行为可能与微生物组活动共同进化的前景诱人,但微生物组的神经行为效应也可能是正常细菌新陈代谢的附带现象。因此,下游效应可能是偶然的,也可能是偶然的宿主对这些过程或产物敏感的结果。
动物的微生物组可以迅速改变宿主的生理机能,而对微生物组的破坏可能会导致一系列健康和疾病状态。如果不了解宿主和微生物组之间的联系,试图纠正与疾病相关的微生物组可能会产生无法预测的问题。行为和微生物群之间新发现的联系凸显了这把潜在的双刃剑的风险和回报。
制版人:珂
参考文献
2. Teng F, Klinger C, Felix K, et al. Gut Microbiota Drive Autoimmune Arthritis by Promoting Differentiation and Migration of Peyer’s Patch T Follicular Helper Cells [J]. Immunity, 2016, 44(4):875-888.
3. Kim S, Kim H, Yim Y S, et al. Maternal gut bacteria promote neurodevelopmental abnormalities in mouse offspring[J]. Nature, 2017, 549(7673):528-532.
4. Vuong H E, Yano J M, Fung T C, et al. The Microbiome and Host Behavior [J]. Annual Review of Neuroscience, 2017, 40(1): annurev-neuro-072116-031347.
5. David O D. Microbial diversityGutsy results [J]. Nature Reviews Microbiology, 2006, 4(3):166-166.
6. Goodrich J, Davenport E, Beaumont M, et al. Genetic Determinants of the Gut Microbiome in UK Twins [J]. Cell Host & Microbe, 2016, 19(5):731-743.
转自:Bioart- 本文固定链接: https://maimengkong.com/zixun/790.html
- 转载请注明: : 萌小白 2021年10月25日 于 卖萌控的博客 发表
- 百度已收录
