撰写:橘子 来源:小张聊科研平台的“ i生信”公众号,微信公众号搜索“ i生信”即可关注/扫描关注见文末
大家好!今天我们来介绍一篇关于溶酶体的综述,该文章发表在Journal of Hematology& Oncology,题目为“Role of lysosomes in physiological activities, diseases, and therapy”,溶酶体长期以来被看作是负责降解、营养感知和免疫的细胞器。最近越来越多的研究表明溶酶体在病理过程中也有重要意义。本文主要介绍溶酶体的生理功能、在疾病过程中的作用机制以及针对溶酶体的潜在治疗方法。目前研究证实溶酶体是从病理角度理解动脉粥样硬化、神经退行性疾病、自身免疫性疾病、胰腺炎、溶酶体贮积症和恶性肿瘤的发病机制以及开发新的治疗策略的关键细胞器。

PART
01
背景介绍
溶酶体是细胞内具有单层膜囊状结构的细胞器,内含磷酸酶、脂酶、蛋白酶、核酸酶、糖苷酶、硫酸酯酶等多种可以非特异性降解胞内大分子的水解酶。这些酶在内质网中合成,并在高尔基体中添加6-磷酸甘露糖作为标记进行翻译后修饰,这是一个靶向溶酶体的标签。溶酶体膜内有质子泵,可利用三磷酸腺苷(ATP)将质子泵进溶酶体,维持溶酶体腔内的酸性环境。溶酶体相关膜蛋白(LAMPs)参与吞噬、自噬、脂质转运和衰老;Toll样受体家族(TLRs)识别病原体相关分子模式并启动炎性反应;哺乳动物雷帕霉素靶蛋白(mTOR)协调多个稳态的信号通路。
溶酶体将自身物质降解并循环利用的过程成为自噬,自噬分为巨自噬(Macroautophagy)、微自噬(Microautophagy)和分子伴侣介导的自噬(Chaperone-mediated autophagy, CMA)。自噬机制的早期阶段是Unc-51-like kinase (ULK)复合体的激活,自噬一旦激活,ULK就会磷酸化III型磷脂酰肌醇3-激酶(PI3K)复合体产生磷脂酰肌醇3-磷酸(PI3P),使自噬相关结合蛋白得以募集。自噬体在微管相关蛋白的作用下与溶酶体融合,溶酶体对其进行消化降解。目前,自噬的机制已被深入研究,自噬功能障碍是很多疾病病理生理过程的一部分,成为疾病防治的新靶点。
综上所述,溶酶体在生理条件下是一些关键细胞活动和信号传导的中心。在动脉粥样硬化、神经退行性疾病、胰腺炎、自身免疫性疾病、溶酶体贮积症和癌症等疾病中,也有溶酶体外相关机制的研究。这些机制之间有不少相似之处,对这些机制的深入了解有助于开发靶向溶酶体的治疗方法。
PART
02
溶酶体在非肿瘤性疾病中的作用机制
动脉粥样硬化
巨噬细胞中的溶酶体在动脉粥样硬化斑块的起始、进展阶段均发挥着作用(Fig.1)。由于斑块的生长及血栓的形成,动脉粥样硬化的发展可能导致冠状动脉综合症、缺血性中风、间歇性跛行和动脉瘤等疾病。动脉粥样硬化过程中,聚集在动脉内膜的巨噬细胞来源的泡沫细胞,吞噬低密度脂蛋白胆固醇(LDL-c)和氧化低密度脂蛋白(oxLDL)是导致慢性炎症的关键。随后,这些细胞可能会程序性死亡,导致覆盖坏死核心的纤维帽破裂,引发血栓的形成。溶酶体几乎参与了动脉粥样硬化的整个过程。由于oxLDL或脂肪酶降低引起的溶酶体功能障碍可能通过调节自噬、炎性体、凋亡和溶酶体的生物发生而导致动脉粥样硬化的病变。自噬通过促进脂滴水解和最终游离胆固醇从泡沫细胞流出,在动脉粥样硬化的发展中显示出其保护作用。动脉粥样硬化斑块的发展也会导致巨噬细胞的自噬,促使胆固醇晶体积累和线粒体功能障碍,自噬受损也会导致线粒体功能障碍,从而产生活性氧(ROS)和细胞色素来诱导细胞凋亡。巨噬细胞或泡沫细胞的凋亡是形成富含脂质的坏死核心的关键步骤。简而言之,激活的炎性体和巨噬细胞的凋亡对动脉粥样硬化斑块的发展都起着至关重要的作用。
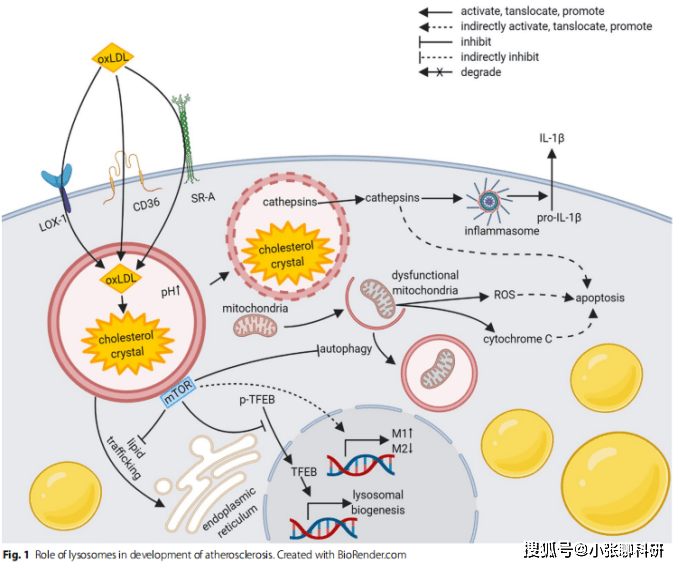
神经退行性疾病
异常蛋白质积聚在神经退行性疾病中较为常见,自噬溶酶体系统(ALP)通过对异常蛋白聚集物和受损细胞器的清除,对未分裂神经元的生存及维持神经系统的稳态至关重要。ALP功能障碍和异常蛋白质积聚是几种神经退行性疾病的常见发病机制,包括阿尔茨海默病(AD)、帕金森病(PD)和亨廷顿病(HD)等。
阿尔茨海默病
阿尔茨海默病(AD)的病理是由细胞外淀粉样斑块中β淀粉样蛋白(Aβ)沉积和磷酸化微管相关蛋白(Tau)形成的神经纤维缠结而成。Tau蛋白的过度磷酸化可能导致神经元微管的不稳定性,引发自噬功能障碍,从而影响溶酶体的位置和功能。淀粉样前体蛋白(APP)可以通过非淀粉样途径或淀粉样途径进行切割,如果溶酶体功能受损或Aβ产生增加,Aβ就会在神经元中积累,导致细胞死亡,从而形成AD的病理性反应。
帕金森病
帕金森病(PD)中错误折叠蛋白质的积累在PD发病机制中起着核心作用,其中以α-突触核蛋白(α-syn)为主要成分的路易小体在神经元内聚集是PD的主要致病因素。分子伴侣介导的自噬和巨自噬途径是降解α-syn蛋白的重要途径,而溶酶体功能障碍导致α-syn聚集,从而引发PD的形成。此外,溶酶体水解酶的基因突变也是该疾病的治病因素之一。
胰腺炎
目前研究证实溶酶体在胰腺炎病理生理中发挥着作用。当腺泡胰蛋白酶原激活时,促分泌素受体或胆盐受体过度激活会导致钙信号异常,扰乱酶原颗粒的胞外分泌,并致使内吞空泡的形成,随后不稳定的内吞空泡破裂,并将胰蛋白酶和组织蛋白酶释放到细胞质中,从而引起细胞凋亡或坏死。然而溶酶体功能障碍和组织蛋白酶在胰腺炎中的参与机制尚存在争议,定量或半定量分析患者或动物模型的自噬活性和组织蛋白酶活性有助于阐明其机制。
溶酶体贮积症
溶酶体贮积症(LSD)是一种异质性的遗传代谢疾病,大部分是由于特定的溶酶体水解酶突变所致。由于溶酶体酶的活性缺陷而不能降解相应底物, 导致水解酶底物的沉积或其次级代谢产物的形成,引起细胞组织及器官功能障碍的一组遗传性代谢病。总之,巨噬细胞内溶酶体异常积聚与巨噬细胞的激活密切相关,巨噬细胞激活可能会产生适宜肿瘤发生的炎性微环境。
溶酶体在肿瘤微环境中的作用
恶性肿瘤成为日益威胁人类健康的因素,治疗的困难不仅在于复杂的肿瘤细胞,还在于由巨噬细胞、T细胞、树突状细胞、成纤维细胞等细胞组成的肿瘤微环境(TME)。TME通过诱导增殖、耐药、侵袭、转移和免疫抑制等促进肿瘤进展,肿瘤的进展和消退高度依赖于TME内各类细胞之间的动态相互作用,而这些相互作用又是通过膜蛋白、细胞因子、代谢物、外泌体等实现的。有研究结果证实溶酶体在TME表型和行为异质性中是不断演进的。
溶酶体对肿瘤细胞增殖的调控
溶酶体通过调控生长因子信号和提供营养物质来调节肿瘤细胞的增殖。生长因子信号由受体酪氨酸激酶(RTK)在质膜上启动,可被溶酶体内吞降解限制。为了维持肿瘤的生长,肿瘤细胞需要比正常细胞更多的营养物质来提供能量和生物合成材料。溶酶体分别通过自噬和大胞饮作用降解回收的细胞内物质和内化细胞外蛋白质以提供氨基酸。总的来说,溶酶体是增殖信号和增殖物质的关键调控因子。
溶酶体对肿瘤细胞侵袭的调控
侵袭是最重要的恶性行为之一,它危及相邻正常组织,与肿瘤转移密切相关,侵袭的关键步骤是细胞外基质的降解。组织蛋白酶是溶酶体中的一个肽酶家族,与侵袭、转移和预后密切相关。肿瘤细胞和基质细胞都能向TME中释放组织蛋白酶,而多数情况下,组织蛋白酶上调导致肿瘤的迁移、侵袭和转移相关,表现为肿瘤进展和预后不良。因此,许多组织蛋白酶已被确定为预后标志物或治疗靶点。
溶酶体对肿瘤细胞放射耐药的调控
放疗目前被广泛应用于恶性肿瘤的治疗中,其治疗效果主要是基于放疗本身对DNA的直接损伤和通过ROS和活性物对DNA的间接损伤。随着DNA损伤,肿瘤细胞会诱导细胞死亡。然而,肿瘤细胞有时会产生放射耐药,导致复发和治疗失败。目前已经发现了几个与放射耐药相关的因素,包括自噬、组织蛋白酶和肿瘤干细胞。自噬反应可能会根据不同的剂量和种类的辐射,以及不同的肿瘤细胞而变化,自噬在放疗后肿瘤细胞中的保护作用已在多种肿瘤细胞中得到验证。
溶酶体对肿瘤细胞耐药的调控作用
药物可以通过被动扩散或主动运输的方式在溶酶体中被隔离,从而阻止药物到达细胞内部。当被动扩散时,溶酶体的腔内pH值约为4.5-5。因此,溶酶体能够隔离亲脂弱碱性药物,而无需转运体的协助。这些药物一旦在溶酶体中积累,由于质子化作用,很难通过溶酶体膜。癌细胞暴露于疏水弱碱药物后,每个细胞的溶酶体数量将会增加。当弱碱药物在溶酶体中积累时,可通过抑制mTOR和转录因子EB (TFEB)的核转位来调控溶酶体的生物发生。因此,开发靶向药物分离方法有助于提高化疗效果。在肿瘤治疗中,是否应该抑制或促进自噬仍有待研究:一方面,激活自噬可导致自噬细胞死亡;另一方面,自噬可保护癌细胞免受化疗伤害。溶酶体在肿瘤细胞中的作用机制如图(Fig.2)所示。
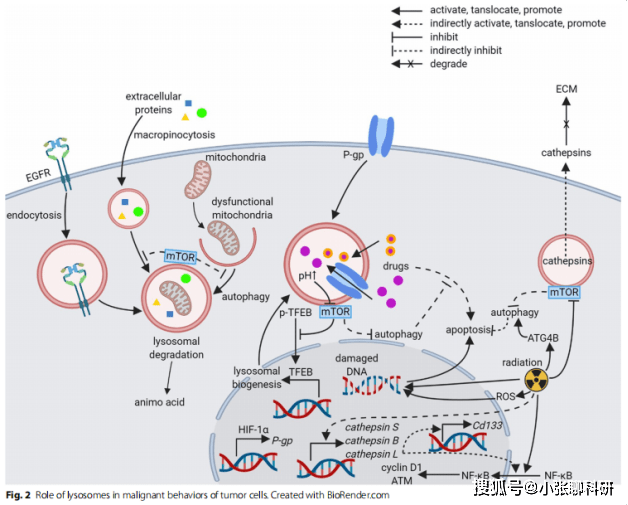
肿瘤相关巨噬细胞中的溶酶体
组织中大量浸润的肿瘤相关巨噬细胞(TAMs)往往与化疗耐药、肿瘤血管生成、免疫抑制、转移和预后不良相关。TAMs的极化被提出用来描述TAMs的不同表型变化,这些表型在不同的环境刺激下可以呈现不同的亚稳态表型。TAMs中的溶酶体已被证实参与巨噬细胞极化调节,以及免疫中介、基质降解和血管生成等过程。
组织蛋白酶在TAMs功能中的作用
在肿瘤微环境中可以大量检测到组织蛋白酶的表达,组织蛋白酶在肿瘤组织中已被证实来源于肿瘤细胞和TAMs。对于TAMs来说,多功能蛋白质可以调控TME中细胞外基质降解、血管生成、耐药以及巨噬细胞募集。组织蛋白酶不仅可以降解溶酶体中的肽,还可以降解细胞外基质,并保持蛋白水解活性。在化疗药物诱导的凋亡途径中,扰乱溶酶体释放到细胞质中的组织蛋白酶是诱导肿瘤细胞死亡的关键。敲除或抑制TAMs来源的组织蛋白酶可能减轻化疗的耐药作用。溶酶体可以调控TAMs的表型,无论是否存在降解相关机制,这些机制都是基于溶酶体实现的,包括膜蛋白、腔蛋白和离子(Fig.3)。基于对这些作用机制的进一步了解,有助于找到潜在的治疗靶点。
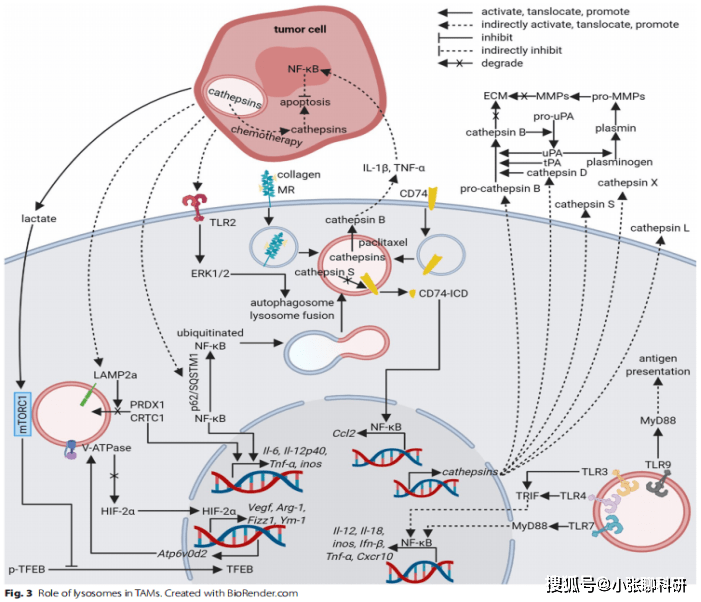
癌症相关成纤维细胞(CAFs)中的溶酶体
在肿瘤中,基质细胞的另一种常见亚型是CAFs,通过氧化应激和NF-κB活化与肿瘤细胞相互作用,分泌大量细胞因子、生长因子和其他因子。CAFs中的自噬通过提供营养物质、保护细胞凋亡和诱导癌细胞的基因组不稳定来促进肿瘤进展。在肿瘤进展过程中,CAF自噬介导的下游机制包括促进化疗耐药性、上皮间质转化(EMT)和癌症干细胞。CAFs与肿瘤细胞通过氧化应激、细胞因子和营养物质而产生的相互作用在很大程度上依赖于自噬,从而引发恶性肿瘤细胞的行为。因此,通过干扰CAFs的自噬有望应用于控制肿瘤的进展。
T细胞中的溶酶体
在肿瘤微环境中,T细胞主要负责杀死肿瘤细胞。细胞毒性T淋巴细胞寻找靶细胞,跟靶细胞接触形成免疫突触,从分泌溶酶体里释放穿孔素和颗粒酶,穿孔素在靶细胞上打孔,颗粒酶从打好的孔进入靶细胞,从而启动多种细胞凋亡途径诱导细胞凋亡。细胞坏死引起的细胞外钾含量的升高会降低T细胞对养分的吸收,从而诱导自噬。而自噬水平的升高引发了代谢和表观遗传重编程,导致T细胞效应功能被抑制,但保留了包括自我更新、扩张和多能性的功能,从而抑制了肿瘤生长。
PART
03
针对溶酶体的新兴治疗策略
随着各种溶酶体在疾病发展中的相关机制的研究,目前提出了针对溶酶体进行治疗的几种策略。第一,酶替代疗法被用于治疗溶酶体贮积症;第二,大量的化学物质能够特异性靶向溶酶体蛋白或与溶酶体相关的信号蛋白,从而调节细胞的行为。第三;有选择性地转染外源核酸或抗原来介导溶酶体蛋白表达或诱导适应性免疫的载体已经被开发出来。
酶替代疗法
溶酶体酶在高尔基网络修饰后,一些胞外酶被吸收并传递给溶酶体,这使得酶替代治疗成为可能。其中重组酶和给药策略在酶替代疗法中都具有重要意义。然而,酶替代疗法的应用仍然面临着巨大的挑战,因为我们缺乏有效的方法来系统地给药,尤其是通过血脑屏障给药。
调节自噬
自噬是动脉粥样硬化、神经退行性疾病、自身免疫性疾病和肿瘤发生发展的关键过程,尤其是在调控巨噬细胞表型方面。在调控自噬通路的一系列蛋白中,mTOR是最主要的靶向蛋白。虽然抑制mTOR会引起自噬,但目前还没有足够的证据证明mTOR抑制剂的抗动脉粥样硬化作用是通过诱导自噬实现的。事实上,更多的研究表明mTOR抑制剂的抗动脉粥样硬化作用与抗炎作用有关。在不同的癌细胞中,自噬与细胞死亡存在正相关和负相关关系。因此,应该谨慎并有针对性地给予自噬抑制剂或诱导剂。
抑制组织蛋白酶
来自肿瘤细胞和TAMs的组织蛋白酶都促进了肿瘤的恶性表型,包括侵袭、EMT、放疗抵抗、血管生成和抗炎TME。比如特异性组织蛋白酶L抑制剂Z-FY-CHO增加了胶质瘤细胞系U251的放射敏感性,一种通用的半胱氨酸组织蛋白酶抑制剂E-64能显著减少肿瘤细胞的侵袭。然而,组织蛋白酶抑制剂的效果并不总是令人满意,副作用可能是由组织蛋白酶的重要生理功能被抑制和非特异性抑制所致。因此,组织蛋白酶抑制剂可能需要特异性给药或局部给药,并与其他疗法结合,如放疗与组织蛋白酶抑制剂的联合可能会提高治疗的效果。
TLR激动剂和其他选择性药物
TLR激动剂与肿瘤PD-1抗体联合应用有望成为免疫治疗的新靶点。目前尽管溶酶体靶向药物已被开发出来,但临床试验中的溶酶体靶向干预措施仍然有限。值得注意的是,这些化合物的副作用和靶标效应是限制其进一步应用的主要问题,暂时和可控的抑制或激活可能有助于限制副作用,因为它们可大限度地减少对重要生理功能的干扰。
PART
04
总结
本文就溶酶体的生理功能、溶酶体在多种疾病过程中的作用以及针对溶酶体的潜在治疗方法作一综述。虽然大量的溶酶体蛋白及其功能已被阐明,但许多机制仍不清楚。进一步的研究将使我们更好地了解脂质在动脉粥样硬化发展中的作用。对于神经退行性疾病,尽管缺陷自噬和潜在的治疗效果已经被揭示,但可靠的传递干预措施是一个巨大的挑战。
在肿瘤治疗中,靶向溶酶体已表现出较好的疗效。如果将这些方法与其他常规治疗相结合,治疗效果可能会进一步改善。值得注意的是,不同阶段、不同细胞的自噬在肿瘤进展中的作用是不同的。我们认为,抑制或刺激自噬的干预措施应谨慎选择,并有针对性地提供。总之,溶酶体是在疾病中发挥至关重要的细胞器,深入理解溶酶体相关机制将有助于开发靶向溶酶体的治疗方法。
参考文献:
J Hematol Oncol. 2021 May 14;14(1):79. doi: 10.1186/s13045-021-01087-1.
原文链接:https://mp.weixin.qq.com/s/6VOz8VPuG_UIuml6k_QWYA- 本文固定链接: https://maimengkong.com/morejc/1199.html
- 转载请注明: : 萌小白 2022年10月1日 于 卖萌控的博客 发表
- 百度已收录
