高通量测序(NGS)技术的发展以及实验通量的不断增加,要求NGS上游样本处理步骤尽可能简便,以提高NGS整个流程的工作效率。转座系统具有快速“剪切、粘贴”、“复制、粘贴”的功能,已被创新应用于NGS领域,如ATAC-Seq(Assay for Transposase-Accessible Chromatin with highthroughput sequencing,利用高通量测序检测转座酶易接近的染色质),LIANTI(Linear Amplification via Transposon Insertion,通过转座子的线性放大),单倍体分型,结构变异检测等,不仅高效简便,有效缩短NGS样本建库时间,实现规模化快速测序,提高测序分辨率,同时能够被灵活改造,应用于更多的技术创新。

图 移花接木——剪切,粘贴
1. 转座因子的发现
20世纪40年代,美国遗传学家芭芭拉.麦克林托克(Barbara McClintock)在某些玉米籽粒中发现了玉米色素显现着一些稀奇古怪的模式。她观察到玉米籽粒颜色的遗传很不稳定,有时籽粒上还出现一些斑斑点点。通过耐心的记录和仔细的分析,她发现使籽粒着色的色素基因是在某一特定代上“接上”或“拉断”的。1951年,在冷泉港生物学专题讨论会上,麦克林托克递交了自己的学术论文,向科学界同行报告了她的新理论,提出遗传基因可以转移,能从染色体的一个位置跳到另一个位置,甚至从一条染色体跳到另一条染色体上。她把这种能自发转移的遗传基因称为“转座因子”,并于1983被授予诺贝尔医学奖。
转座因子的发现改变了人们对基因组序列稳定性的认识。自此以后,人们已经在生物界各个领域证实了转座子系统的广泛存在,并将转座子系统开发成为各种生物基因分析的有效工具之一,极大促进了遗传学的发展。

图 Barbara McClintock
转座因子(转座子)根据其功能是“复制-粘贴”还是“剪切-粘贴”分为I型转座子和II型转座子两类。I型转座子的转座中间体是RNA,II型转座中间体是DNA。II型转座子,尤其是来源于细菌的Tn5转座子,是NGS领域最常用的转座子。
2. 转座子Tn5的转座事件
Tn5转座子是一种细菌转座子,最早由E. coli中发现,是一段含有若干抗性基因和编码转座酶基因的DNA片段(a)。其中IS50R和IS50L的序列高度同源,只是IS50L的一个碱基存在突变。IS50具有19bp的倒置末端(外末端outside end,OE和内末端inside end,IE),两末端倒置有7个碱基不同。此倒置末端是转座酶(Tnp)的作用位点。IS50L和IS50R均含有编码转座酶(TnP)以及转座阻遏蛋白(lnh)的基因,但由于IS50L中的碱基突变,造成翻译提前终止,所以仅有IS50R可以产生正常的有活性的TnP和lnh。
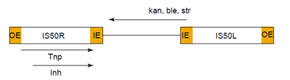
图 Tn5转座子结构
转座事件发生时,两个转座酶(Tnp)分子(绿色标注)结合到Tn5转座子的OE末端(黄色标注),形成两个Tnp-OE复合体,随后两个复合体通过Tnp的C末端相互作用进行联会,形成一个Tn5转座复合体,此时Tnp产生切割DNA的活性。随后Tnp利用切割活性,经过一系列化学反应切除供体DNA,离开供体链。当结合到靶DNA上时,Tn5转座复合体识别并攻击靶序列(Target site),将转座子插入到靶序列中,粘性末端通过DNA聚合酶、连接酶作用进行填补,两端形成9bp正向重复序列。整个转座过程完成了基因从原始DNA被剪切之后粘贴在另一受体DNA的过程,实现了基因的“跳跃”。
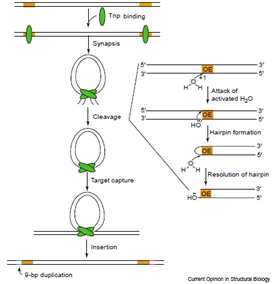
图 Tn5转座机理
3. 转座子Tn5用于NGS文库构建
NGS文库构建即把DNA样本片段化或筛分成指定长度的目标序列,再加上寡核苷酸接头P5、P7(和条形码Barcode),用于后续测序上机。传统建库方式需要经过DNA片段化、末端修复、接头连接、文库扩增、多次纯化分选等步骤,耗时较长,将Tn5用于测序文库构建时,可将DNA片段化、末端修复、接头连接等多步反应转变为1步反应,极大缩短建库时间,提高工作效率。
Tn5用于NGS建库的体外转座要素包含:转座子的末端序列、靶DNA、转座酶(Tnp)和Mg2+(激活剂),转座法建库形成的文库结构如下:

图 转座法建库文库结构
将P5、P7端部分接头序列(Adapter 1/2)+转座子末端序列设计合成供体DNA,Tnp识别转座子末端形成带有P5、P7端部分接头的Tn5转座复合体(见下图)。该复合体识别受体DNA的靶序列(Target site),切断受体DNA,并插入携带的供体DNA,形成一端带有P5部分接头Adapter 1,一端带有P7部分接头Adapter 2的DNA,之后通过PCR加上Barcode以及接头其余部分,形成含P5端与P7端完整接头的DNA文库。
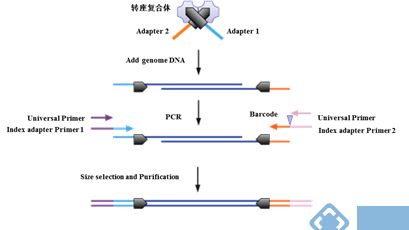
图 Tn5转座系统用于文库构建
4. Tn5转座的前沿应用
1)ATAC-Seq
ATAC-seq,全称为Assay for Transposase-Accessible Chromatin with highthroughput sequencing,即利用高通量测序检测转座酶易接近的染色质)的技术。真核生物的核DNA并不是裸露的,而是有蛋白质即组蛋白与之相结合的。DNA一圈一圈得缠绕在组蛋白上,形成串珠式的结构。而这样的结构还能够进一步折叠、浓聚,并在其他架构蛋白的辅助下,形成染色体。当需要进行DNA的复制或者转录时,DNA的折叠结构会被打开形成可接近区域,此时,ATAC-seq技术使用Tn5转座酶进入并切割下暴露的DNA并同时连接上特异性的Adapters,连接上Adaptors的DNA片段被分离出来用于二代测序,从而获得大量的细胞系和组织样本基因表达、转录调控、转录修饰等的信息。相对其他如MNase-seq,FAIRE-seq和DNase-seq等染色质研究方法来说,ATAC-seq具有快速、样本需求量少、一次性获得全基因组上的染色质开放区域等优势,在表观遗传学具有广阔的发展前景。
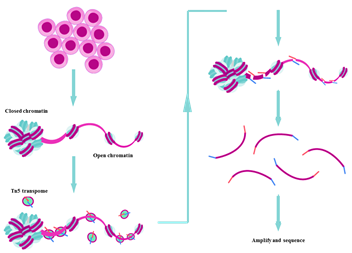
图 ATAC-seq原理
延伸阅读:
[1] Buenrostro JD, Giresi PG, Zaba LC, Chang HY, Greenleaf WJ. Transposition of native chromatin for multimodal regulatory analysis and personal epigenomics. Nature methods. 2013;10(12):1213-1218. doi:10.1038/nmeth.2688.
[2] Buenrostro, JD., Wu, B., Chang, H. Y.&Greenleaf, W. J. ATAC-seq: A Method for Assaying Chromatin Accessibility Genome-Wide. Curr. Protoc. Mol. Biol. 109, 21.29.1-9 (2015).
[3] Combining ATAC-seq with nuclei sorting for discovery of cis-regulatory regions in plant genomes. Nucleic Acids Research, 2017.
2)LIANTI
LIANTI,全称为Linear Amplification via Transposon Insertion,即通过转座子的线性放大,是一项经过改良的单细胞全基因组扩增(whole-genome amplification,WGA)方法。 LIANTI法首先利用Tn5转座子结合LIANTI序列,形成Tn5转座复合体(含T7启动子),之后该复合体随机插入单细胞基因组DNA,经转座后,将DNA随机片段化并连接T7启动子。随后T7启动子行使体外转录功能,用转录获得大量线性扩增的转录本,转录本再经过逆转录之后得到大量的扩增产物,随后进行正常的建库测序操作。整个过程仅进行线性扩增,没有进行指数扩增,大大增强了扩增稳定性,降低PCR干扰,此外,该技术将该放法将测量拷贝数的空间分辨率提高了3个数量级(能在千碱基分辨率进行微CNV检测,基因组覆盖率可达到97%),助力更有效、更精准地检测出更多遗传疾病。
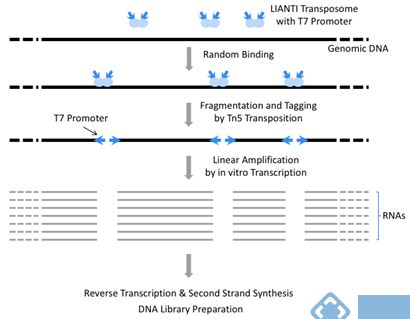
图 LIANTI原理
延伸阅读:
[1] Chen, C., Xing, D., Tan, L., Li, H., Zhou, G., Huang, L., & Xie, X. S. (2017). Single-cell whole-genome analyses by Linear Amplification via Transposon Insertion (LIANTI). Science, 356(6334), 189-194.
5. 结语
转座参与的普通建库技术,有效缩短了建库时间,满足了测序市场对大规模样本处理速度的需求,而转座参与的特定研究方向建库技术,如ATAC-Seq、LIANTI、CPT-seq等,则更多的满足了科研人员们对于科学研究的需求。目前转座子/转座酶的技术应用在NGS领域还只是冰山一角,相信未来转座酶/转座子的可改造性会为NGS提供了更多的可能。
6. 参考文献
Single-cell whole-genome analyses by Linear Amplification via Transposon Insertion (LIANTI).
ATAC-seq: A Method for Assaying Chromatin Accessibility Genome-Wide.
Transposons Tn10 and Tn5.
Structure/function insights into Tn5 transposition.
Transposons: Mobile DNA.- 本文固定链接: https://maimengkong.com/learn/1139.html
- 转载请注明: : 萌小白 2022年8月6日 于 卖萌控的博客 发表
- 百度已收录
