通常跑胶分为跑琼脂糖胶和 SDS-PAGE 胶,当然也还有非变性胶,这里主要说明上面两种。
琼脂糖凝胶电泳
一、原理
琼脂糖是 D-和 L-半乳糖残基通过糖苷键交替构成的线状聚合物,且琼脂糖凝胶具有三维网络结构,物质分子通过时会受到阻力,不同的大小的带电物质在电场下涌动时受到的阻力不同,因此在凝胶电泳中,带电颗粒的分离不仅取决于净电荷的性质和数量,而且还取决于分子大小,这就大大提高了分辨能力。
一般用于分离核酸分子,同时不同构象的核酸的迁移速率也不一样,超螺旋环状>切口环状>线状。不同浓度的胶适用的分离范围也不一样。
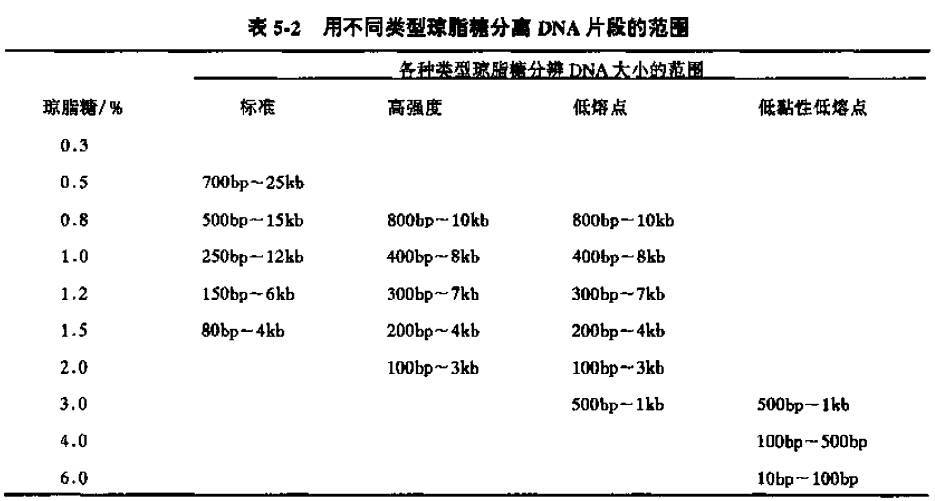
(via《分子克隆实验指南 第三版》)
二、制胶
这里以 1% 琼脂糖胶为例
缓冲 TBE:Tris-硼酸(TBE)
使用液
0.5X:0.045mol/L Tris-硼酸
0.001mol/L EDTA(pH8.0)
储存液(1 000 ml)
5X:54 g Tris 碱
27.5 g 硼酸
20 ml 0.5mol/L EDTA(pH8.0)
TBE 尽量用 5X 储存,10X 的比较容易沉淀。
染料:溴化乙锭或 SYBR GOLD
制胶的第一步是选好梳齿,将胶架放上胶板,再放上梳齿。梳齿决定了胶的孔道的大小,尽量选择厚的梳齿,梳齿的间距较大的,这样一来既可以增加上样量又能避免上样时枪头不小心破坏了胶孔。

各种梳齿
第二步是取稀释成 0.5X 的 TBE 25 ml,1000X 染料 2.5ul(根据具体染料的乘数来定),0.25 g 的琼脂糖,放入在厚玻璃瓶中,用微波炉对其加热至液体中没有颗粒。
第三步是趁热加到胶架上,调整梳齿(不要使梳齿靠到两边,不然挨着的孔会不能用了),赶气泡(用枪头将气泡赶到边缘,不然凝固的胶中有气泡若在孔道中将会影响到样的电泳速度,得到的条带会不平整)。
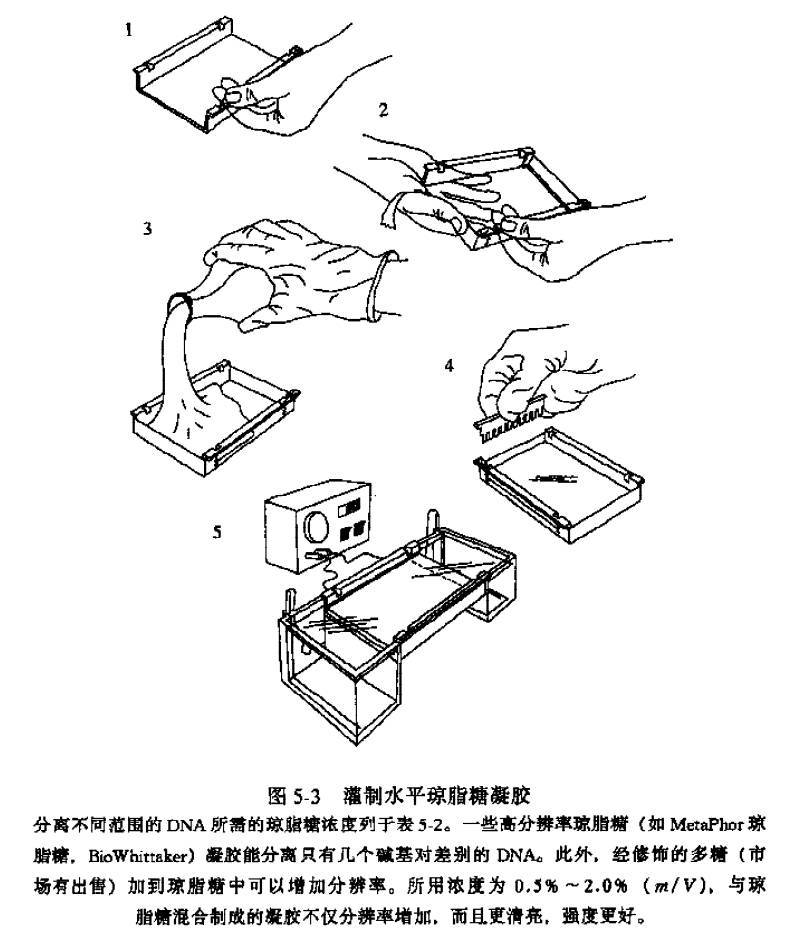
灌制水平琼脂糖凝胶(via《分子克隆实验指南 第三版》)
三、上样
待胶凝固好了,将胶架取下来放到电泳槽中,(若有多余的孔道可以切下来放入一次性手套中在 4 度保存),用 0.5XTBE 覆盖胶。
然后上样 Maker(根据你的样的大小来定)最多 10 ul(如果你的样的上样量少可以酌情减少,这样之后跑完胶照相是条带的相对亮度会更好);
样(处理,用 loading buffer,根据 buf 的乘数来定)最多 20 ul 就足够了。将胶摆正,盖上盖接上电源后(注意胶的摆放一定是向正极跑,不然你的样都跑出去了,你就苦逼了)。
调好电压和时间,一般为 110 V,不同的 DNA 大小不同时间也不太一样,但原则上使 maker 跑到胶的 2/3 处就可以了。
四、拍照
用凝胶成像仪,调整好曝光度,保存条带亮度差不多的即可。
SDS-聚丙烯酰胺凝胶
(SDS-PAGE 胶)
一、原理
SDS-聚丙烯酰胺凝胶电泳,其中 SDS 能断裂分子内和分子间氢键,破坏蛋白质的二级和三级结构,强还原剂能使半胱氨酸之间的二硫键断裂,蛋白质在一定浓度的含有强还原剂的 SDS 溶液中,与 SDS 分子按比例结合,形成带负电荷的 SDS-蛋白质复合物,这种复合物会使蛋白质丧失了原有的电荷状态形成仅保持原有分子大小为特征的负离子团块。
从而降低或消除了各种蛋白质分子之间天然的电荷差异,由于 SDS 与蛋白质的结合是按重量成比例的,因此在进行电泳时,蛋白质分子的迁移速度取决于分子大小。
SDS 聚丙烯酰胺凝胶电泳的有效分离范围取决于胶的聚丙烯酰胺的浓度与交联度。

☞ 各种需要用到的溶液配方
考马斯亮蓝染液
在 90 ml 甲醇:水(体积比 1:1)和 10 ml 冰乙酸混合液中溶解 0.25 g 考马斯亮蓝 R-250。用 0.45/0.22um 的膜抽滤,室温保存。
脱色液
在 90 ml 甲醇:水(体积比 1:1)和 10 ml 冰乙酸混合液用 0.45/0.22um 的膜抽滤,室温保存。
1X Tris-甘氨酸电泳缓冲液 (即 Running buffer)25 mmol/L Tris
250 mmol/L 甘氨酸
0.1%(m/V)SDS
同样可以扩大配方为 5X 的储存液。
30% 丙烯酰胺混合液(100 ml)
29.2 g 丙烯酰胺(Acr)
0.8 g 亚甲基双丙烯酰胺(Bis)
10 g SDS 外包锡纸,4℃ 冰箱保存
二、制胶
选择胶板(0.75 mm 或 0.1 mm 的,上样量会有些差别,新手的话推荐 0.1 mm)制胶前先将胶板刷干净,装上以后用水先验漏(5-10 min)然后倒掉水且从侧边将水用滤纸吸干。
根据你的蛋白大小来选择一定浓度的胶。
注意最后加入 TEMED(N,N,N’,N’-四甲基乙二胺)(因为 TEMED 能够通过催化过硫酸铵形成自由基而加速丙烯酰胺的聚合)先配下层胶每块胶 5 ml,加到固定架子的夹子处即可(图中紫色线所在的位置),然后用加水将胶压平。
等待胶干(通过未加完的液来判断)然后是上层的积层胶,先将上层水倒出吸干,再将积层胶加入,立即在其中插入一块干净的梳子,注意不要混入气泡,然后在家一些积层胶溶液彻底填满梳子之间的空隙,将胶垂直放置等待胶凝固。

☞ 配方如下
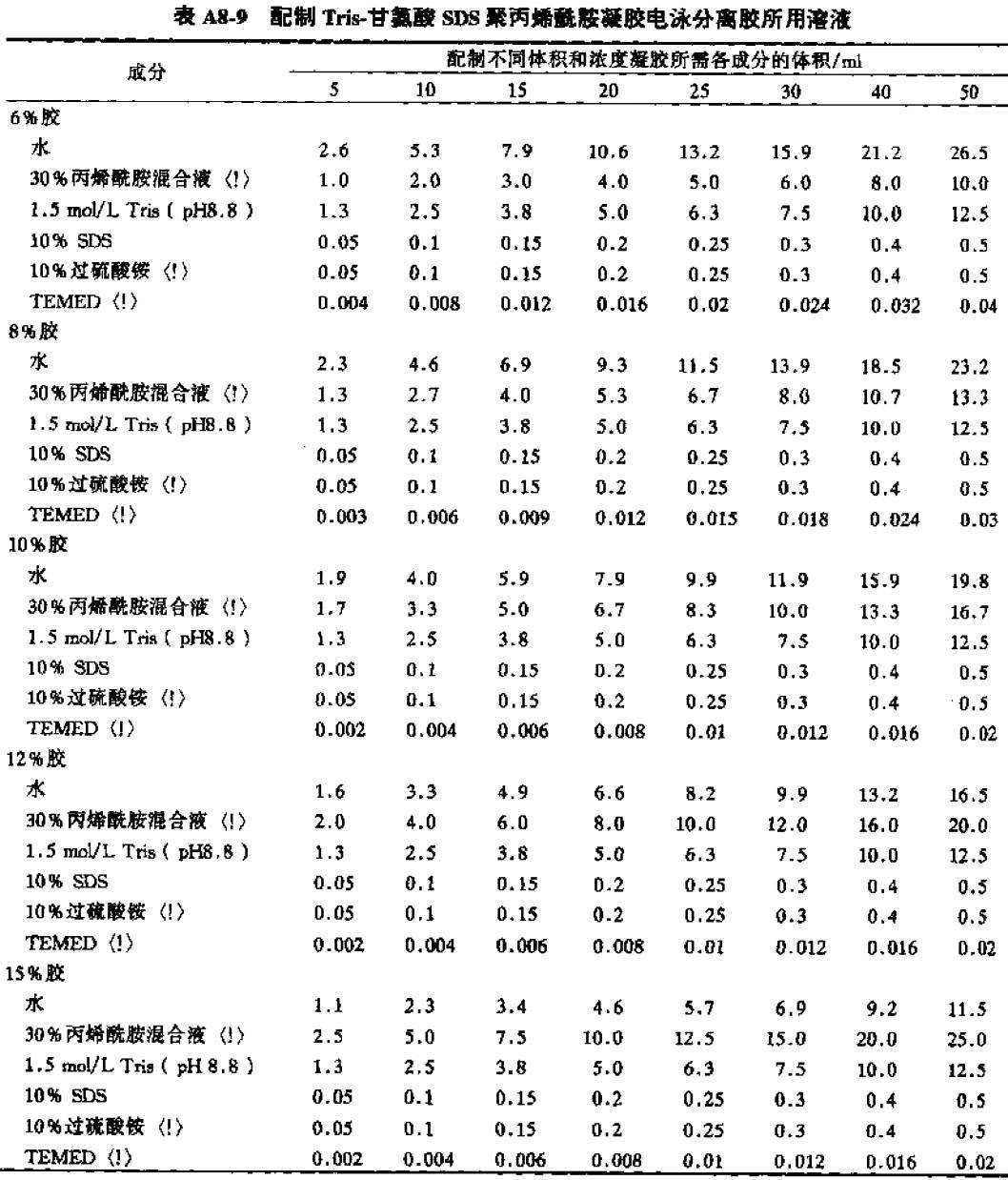
下层胶(via《分子克隆实验指南 第三版》)
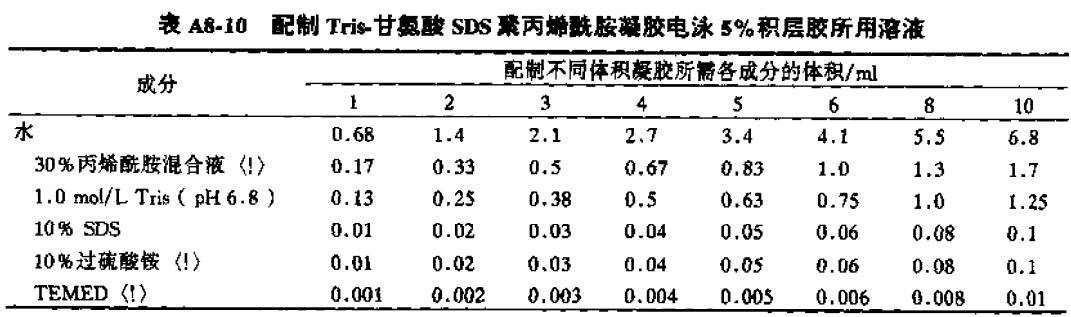
上层胶(via《分子克隆实验指南 第三版》)
每块胶需配 1 ml,新手可配 2 ml,以防插梳齿时不顺,还可以有补救的机会,同样注意最后加入 TEMED,最后将液用枪均匀打入即可,待干了后即使用。
☞ 样品处理
e.g. 6XSDS-PAGE 上样缓冲 4 ul+蛋白液 20 ul 与小 EP 管中,将其放入沸水中 5 mln,再 8 000 r 离心 5 min。若有多余的孔道可以用上样缓冲+水的混合物来填充。
☞ 装好跑胶装置
将胶专门的夹子夹住注意一定两面均要夹上且夹紧,将整个胶架放入电泳槽中,先加入 running buffer 电泳槽至夹脚上方一点即可,再向胶中加入 running buffer。不要急于加样,可以缓个几分钟看看是否漏液,漏的话需要重新用夹子固定胶。若不漏液,小心地将梳子拔下。
三、上样
上样尽量选枪头细的枪,maker 最多上 10ul(条带就很深了),上蛋白样 10-20ul 均可(但其他孔道一定要保持一致,这样才能保证各个孔道的条带的平整),多出来的孔道要用上样缓冲稀释液来填充,不然最边上的条带会跑的歪向一边,条带会很丑。
☞ 跑胶
电压一般设置 110 V,其他也是可以的,一般 85~150 V 都问题不大,电压太大速度快但会产热大,电压太小速度太慢。根据所跑的目的蛋白的大小来定时间,若蛋白大小超过 100 kDa,可以让蓝色上样缓冲跑出来后,再跑上 20 min;若蛋白的大小小于 15 kDa,则使蓝色到整块胶 4/5 处就可以停止了;若蛋白大小介于 15-100 kDa 之间,则使蓝色到胶的末尾即可。这样的目的是跑出来的目的条带尽可能的处于相对中间的位置。
四、拍照
有些上样缓冲中会加有免染的染料,就可以直接通过凝胶成像仪来直接成像。对于一般的情况还是要通过考染(将凝胶浸泡在至少 5 倍体积的染色液中,置平缓摇动的平台上温室染色至少 4 小时),在用脱色液褪色(同样也要在水平的混匀仪器上摇)后在用凝胶成像仪来看即可。
- 本文固定链接: https://maimengkong.com/kyjc/719.html
- 转载请注明: : 萌小白 2021年7月20日 于 卖萌控的博客 发表
- 百度已收录
