癌症是一种多阶段的遗传和表观遗传疾病,病因复杂,涉及癌基因和抑癌基因的突变、下调、过表达和缺失等多方面[1]。癌症基因组学的发展已经确认了数千个可能的癌症驱动基因(driver gene),这些基因的突变可以促进肿瘤的发生。一个典型的肿瘤包含2到8个这样的“驱动基因”突变,剩下的突变则是不提供选择性生长优势的“乘客”,驱动基因调节着肿瘤的细胞命运、细胞存活和基因组维持等重要的细胞过程[2],更好地理解这些基因发挥作用的机制是基础癌症研究中最紧迫的需求之一。

现有的用于研究癌症生物学特性的体内和体外模型都被时间证明是有效的,但是每种模型又有其局限性,例如基因工程小鼠模型虽然考虑到了肿瘤生长及其微环境,但是受到可量化性、时间和成本的限制[3];基于异种移植的模型则在规模上受到限制,而且在体外很难操作;体外二维单层细胞培养(2D细胞培养)常用于对肿瘤生长和药物敏感性等的基因组水平的研究,但其缺乏疾病的很多特征,包括缺氧[4]、细胞相互接触改变[5]和代谢重编程[6]等,而体外类器官模型(即3D细胞培养)可以缓解这些担忧,但是其可量化性存在缺陷。如何选择癌症研究的模型成为不可忽视的问题,开发高通量和精确的模型来研究驱动基因的功能是目前一个主要的挑战。
近日,来自美国斯坦福大学医学院的Michael C。 Bassik教授团队的一项研究就为我们在选择癌症研究模型时提供了一些警示与启示,这项研究在线发表于Nature杂志,题为“CRISPR screens in cancer spheroids identify 3D growth-specific vulnerabilities”。该研究设计了一个可量化的3D肺癌模型,并通过全基因组CRISPR筛选发现2D肺癌细胞培养与3D肺癌模型之间存在的基因差异,尤其是突变基因的差异巨大,指出3D模型可以更准确的再现体内肿瘤的表型,从而建立了一套在3D球状癌症模型中执行CRISPR筛选以揭示癌症特性的通用策略。

目前在2D单层细胞培养中进行的CRISPR筛选已经产生了大量的信息,但是却往往不能复制肿瘤生物学的关键方面,因此,本文的研究人员首先利用肺腺癌细胞系H23(存在KRASG12C突变),通过优化接种密度和甲基纤维素浓度,开发了一个可量化的3D肺癌球状模型;然后利用全基因组CRISPR结合KRASG12C抑制剂ARS-853分别对2D培养和3D培养的肺癌细胞进行筛选(图1)。分析结果显示,全基因组CRISPR筛选下,3D培养细胞更多地呈现生长加快的表型,而2D培养的细胞则大多表现为生长抑制。同时,致癌基因和肿瘤抑制因子的表型在2D培养的细胞中均表现为生长抑制;但在3D培养的细胞中的表现差异明显,肿瘤抑制因子的敲除使得细胞生长变快。
此外,通路富集分析也在两者间出现明显差别,3D培养细胞以癌症特异性通路(如p53和Ras通路)富集为主,而2D培养细胞富集的通路则普遍涉及重要细胞功能,如DNA复制。由此表明3D培养能更准确地获得癌症相关基因及通路的特征。进一步地分析发现,这些在2D和3D培养条件下具有敏感性差异的基因大部分富集在肺癌突变基因中,由此也提示利用3D癌症模型对具有不同效应的基因进行分析,将有可能增强识别癌症驱动基因的能力。
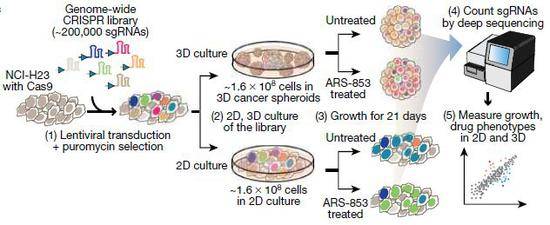 图1 H23细胞中CRISPR筛选流程图
图1 H23细胞中CRISPR筛选流程图
与此同时,若将3D培养细胞的表型与相对应的2D培养细胞的表型进行标准化(3D/2D),上述这些效应将变得更加明显。究其原因可能有二个:第一,利用2D培养细胞的表型将3D培养细胞的表型进行标准化,可以最小化对两者细胞生长都至关重要的核心必需基因在其他方面的主导作用,从而更好地揭示肿瘤特异性基因;第二,如之前研究所假设的,3D球状培养可能可以更好地模拟体内肿瘤。而本文进一步的实验分析也表明,来自3D培养细胞筛选出的基因表型与小鼠异种移植模型的基因表型的相关性,明显高于其与来自2D培养细胞中筛选出的基因表型的相关性。当然,比较其他肺癌细胞系的不同培养模型也能得出类似的结果。
既然具有很强的3D/2D表型的基因会因肺癌突变而富集,那么是否可以从中找到新的治疗靶点呢?答案是肯定的。在2D培养模型中不存在差异,但是在3D培养模型中存在明显表型的基因——羧肽酶D(CPD)(图2),是金属羧酸肽酶家族中特征相对不明显的一员,它能从多肽中裂解C末端精氨酸和赖氨酸。实验表明,CPD的表达与肺癌患者的预后相关,而CPD的缺失可以有效地抑制肿瘤的生长,并且其缺失表现出与KRASG12C抑制剂ARS-853明显的联合致死效果,尤其是在3D培养中。进一步实验证实,CPD的这种作用是通过调节胰岛素样生长因子1受体(IGF1R)实现的,它可以从IGF1R的α链上去除对其受体活性至关重要的C-末端RKRR基序,从而影响IGF1R的成熟与功能。由此也表明IGF1R的表达和/或依赖性以及KRAS的突变可能作为肺癌靶向CPD和KRASG12C联合治疗的生物标志物。
 图2不同培养模型中引起表型的基因
图2不同培养模型中引起表型的基因
- 本文固定链接: https://maimengkong.com/kyjc/1485.html
- 转载请注明: : 萌小白 2023年4月28日 于 卖萌控的博客 发表
- 百度已收录
