起始材料:RNA
定量逆转录PCR(quantitative reverse tranion PCR, RT-qPCR)是应用于以RNA作为起始材料的PCR实验中的一种实验方法。 在该方法中,总RNA或信使RNA(mRNA)首先通过逆转录酶转录成互补DNA(cDNA)。随后,以cDNA为模板进行qPCR反应。RT-qPCR已被用于多种分子生物学的应用中,其中包括基因表达分析、RNA干扰验证、微阵列验证、病原体检测、基因测试和疾病研究。
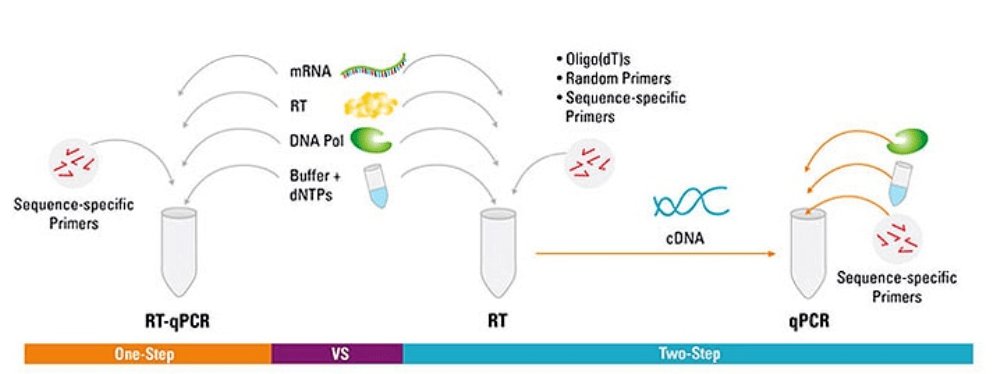
RT-qPCR的一步法与两步法
RT-qPCR可通过一步法或两步法来完成。一步法RT-qPCR把逆转录与PCR扩增结合在一起,使逆转录酶与DNA聚合酶在 同一管内同样缓冲液条件下完成反应。一步法RT-qPCR只需要利用序列特异性引物。在两步法RT-qPCR中,逆转录和PCR扩增过程是在 两个管中完成,使用不同的优化的缓冲液、反应条件、以及引物设计策略。
|
|
优点 | 缺点 |
|---|---|---|
| 一步法 |
|
|
| 两步法 |
|
|
总RNA与mRNA的选择
在设计RT-qPCR实验过程中,决定是否要使用总RNA或纯化的mRNA作为模板进行逆转录十分重要。尽管mRNA可能能够提供略高的灵敏度,但总RNA仍经常使用。其原因是 总RNA作为起始材料具有较mRNA更重要的优势。首先,其过程需要较少的纯化步骤,这确保了更好的定量回收模板和更好的把结果标准化为起始的细胞数。其次,其避免mRNA富集步骤,这能够避免由于不同mRNA的回收率不同而带来的结果偏移的可能性。总的来说,由于在大多数的应用中,目标基因的相对定量比检测的绝对灵敏度更为重要,因此在大多数情况下,总RNA更适用。
逆转录引物
在两步法中,有 三种不同的方法可用于引发cDNA反应:oligo(dT)引物、随机引物、或序列特异性引物。通常情况下,是将oligo(dT)引物和随机引物进行混合使用。这些引物退火至模板mRNA链,并提供给逆转录酶一个用于合成的起点位置。
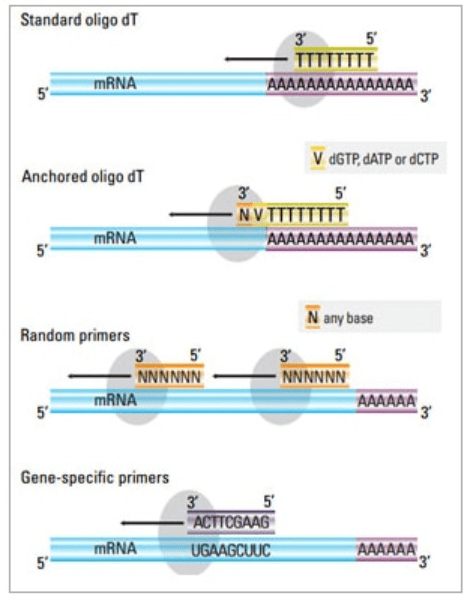
| 引物选择 | 结构与功能 | 优点 | 缺点 |
|---|---|---|---|
| Oligo(dT) 引物(或锚定 oligo(dT) 引物) | 延展退火至 mRNA poly(A) 尾部的胸腺嘧啶残基;锚定 oligo(dT) 引物的3’端包含一个G、C或A (锚定位点) |
|
|
| 随机引物 | 长度为6至9个碱基,在 RNA 转录过程中,其可退火至多个位点 |
|
|
| 序列特异性引物 | 靶向特异的 mRNA 序列的定制引物 |
|
|
逆转录酶
逆转录酶是利用 RNA合成DNA的一种酶。 一部分逆转录酶具有RNA酶活性,能够在转录后降解RNA-DNA杂交链中的RNA链。如果其不具有Rnase酶活性,可加入RNaseH以获得更高的qPCR效率。常用的酶包括莫洛尼鼠白血病病毒逆转录酶和禽成髓细胞瘤病毒逆转录酶。对于RT-qPCR来说,理想的情况下是选择具有较高热稳定性的逆转录酶,这样cDNA的合成能够在较高的温度下进行,确保成功转录具有较高二级结构的RNA,同时保持其在整个反应过程中的全部活性,从而得到更高的cDNA 产量。
逆转录酶的RNase H活性
RNaseH能够 从RNA-DNA双链中降解RNA链,从而允许双链DNA的有效合成。然而,当使用长mRNA作为模板,RNA可能被过早的降解,从而导致截短的cDNA。因此,在cDNA克隆过程中,如果需要合成长的转录物时,尽量减小 RNaseH的活性通常是有益的。与此相反,拥有RNase H活性的逆转录酶通常有利于qPCR的应用,因为它们能够在PCR的第一个循环中提高RNA-DNA双链的熔解。
引物设计
用于RT-qPCR中qPCR步骤的PCR引物 最好应设计成跨越一个外显子-外显子连接,其中一条扩增引物可以潜在地跨越实际外显子-内含子边界。由于含内含子的基因组DNA序列不会被扩增,因此这种设计可以减少从污染的基因组DNA中扩增得到的假阳性的风险。
如果引物不能被设计成能够分离外显子或外显子-外显子边界,则有必要利用无 RNA酶的DNA酶I或dsDNA酶处理RNA样品以除去基因组DNA 污染。
RT-qPCR对照
一个逆转录阴性对照(-RT对照)应该包括在所有的RT-qPCR的实验中, 以检测 DNA污染(如基因组 DNA 或来自之前反应的PCR 产物)。这一对照包含除逆转录酶之外的所有反应组分。由于该对照不会发生逆转录,因此如果观察到 PCR扩增,则极有可能来自DNA的污染。
- 本文固定链接: https://maimengkong.com/kyjc/1227.html
- 转载请注明: : 萌小白 2022年10月3日 于 卖萌控的博客 发表
- 百度已收录
