
肺纤维化是一种慢性、进行性的肺部疾病,临床治疗难度大[1-2]。流行病学调查显示,近10年来肺纤维化的发病率逐渐上升,尤其是在老年人群中更为普遍[3-4]。现代医学研究显示,纤维化可被描述为一种不合理的损伤修复形式,持续性的肺泡上皮细胞损伤、修复异常、成纤维细胞的增殖和细胞外基质的积累会导致肺结构紊乱和肺纤维化的形成。虽然特发性肺纤维化的发病机制尚不完全清楚,但已有大量研究表明,肺泡上皮-间质转化(epithelial-mesenchymal transitions,EMT)在肺纤维化的形成和发展中具有重要作用[5-7]。目前,临床治疗肺纤维化的药物非常少,主要有吡非尼酮和尼达尼布等,但这些药物的疗效和安全性并不令人满意[7-8]。
近年来,传统中医药在抗肺纤维化方面取得了一定进展,相关研究报道逐渐增多[9-11]。川贝母Fritillariae Cirrhosae Bulbus自古以来是临床化痰止咳和消痈散结良药,现代临床也用于改善肺纤维化。然而,川贝母的药理作用机制研究非常薄弱,现有文献报道主要集中在“止咳化痰”方面[12-13],关于川贝母抗肺纤维化的研究几乎一片空白[14]。随着临床抗肺纤维化需求的增多,开展川贝母在抗肺纤维化方面的药理作用机制研究对于支撑其在临床科学合理用药提供实验证据支撑是非常必要的。空间代谢组学是一种基于质谱成像技术的代谢组学分析方法,与现有常规代谢组学分析方法相比,该方法具备原位定性和定量分析化合物的能力,并保留化合物的空间维度信息,能够获得样本特定区域目标物的空间分布谱图,从而深入挖掘代谢物在样本中的空间分布情况和代谢过程中的差异变化[15-17]。课题组前期研究表明川贝母对博来霉素诱导的大鼠肺纤维化确有一定的改善作用,但其作用机制尚不完全清楚,因此课题组进一步采用空间代谢组学研究其抗肺纤维化可能的作用机制,并用药理实验指标进行验证,以期为探寻川贝母抗肺纤维化的药理作用机制提供一些参考。
1 材料
1.1 动物
SPF级雄性SD大鼠60只,体质量(180±10)g。所有大鼠均由四川省中医药科学院动物实验中心提供,合格证号SCXK(川)2018-19,所有大鼠均经动物检验检疫合格。动物于温度22~26 ℃、相对湿度35%~50%的环境下饲养。动物实验经四川省中医药科学院伦理委员会批准[批准号SYLL(2022)-017]。
1.2 药材
川贝母采自四川省广元市,经四川省中医药科学院谭鹏副研究员鉴定为百合科植物太白贝母Fritillaria taipaiensisP. Y. Li的干燥鳞茎。
1.3 药品与试剂
硫酸博来霉素(批号TB002314)、改良Masson三色染色液(批号0420A22)购自合肥博美生物科技有限责任公司;4%甲醛固定液(批号22192875)购自武汉博士德生物公司;化学发光试剂盒(批号H31500-1)购自天地人和生物科技有限公司;牛血清白蛋白(批号4240GR250)购自德国BIOFROXX公司;TMEDA(批号CAS110-18-9)购自KESHI公司;大鼠转化生长因子-β1(transforming growth factor-β1,TGF-β1)ELISA试剂盒(批号ZC-37645)购自上海茁彩生物科技有限公司;总蛋白测定试剂盒(批号A045-2-2)、羟脯氨酸(hydroxyproline,HYP)测定试剂盒(批号A030-2-1)均购自南京建成生物工程研究所;Cryo-Gel冷冻切片包埋剂购自德国Leica公司;0.5%伊红染液水溶液、苏木素染色液购自美国Sigma公司;靛蓝染色液购自上海启中信息有限公司;α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)一抗(批号700068)、E-钙黏蛋白(E-cadherin)一抗(批号201283)、β-肌动蛋白(β-actin)一抗(批号700068)、HRP标记的山羊抗鼠二抗(批号511103)、HRP标记的山羊抗兔二抗(批号511203)均购自成都正能生物技术有限公司;Smad 2蛋白一抗(批号A16912)购自武汉爱博泰克生物科技有限公司;Smad 3蛋白一抗(批号NB10056479ss)购自美国NOVUS公司;磷酸化Smad 2(p-Smad 2)一抗(批号ab188334)、磷酸化Smad 3(p-Smad 3)一抗(批号ab52903)均购自英国Abcam公司;蛋白激酶B(protein kinase B,Akt)一抗(批号60203-2-Ig)、磷酸化Akt(p-Akt)一抗(批号66444-1-Ag)、α-SMA一抗(批号201283)均购自美国Proteintech公司。
1.4 仪器
空气动力辅助解吸电喷雾离子化质谱成像平台(北京维科托科技有限公司);Q-Exactive Orbitrap质谱仪、MK3型酶标仪、Superfrost Plus型正电荷防脱载玻片(美国Thermo Fisher Scientific公司);JT-12S型自动脱水机(武汉俊杰电子有限公司);BMJ-A型组织包埋机、PHY-Ⅲ型病理组织漂烘仪(常州市中威电子仪器有限公司);RS36型全自动染色机(常州派斯杰医疗设备有限公司);Pannoramic 250型数字切片扫描仪(匈牙利3DHISTECH公司);KZ-II型高通量组织匀浆仪、KZ-III-F型高速低温组织研磨仪(武汉赛维尔生物科技有限公司);D3024R型台式高速冷冻型微型离心机(美国SCILOGEX公司);61006-9Q型凝胶成像系统(上海勤翔科学仪器有限公司);SW-CJ-1D型超净工作台(苏州安泰空气技术有限公司);K5800C型超微量核酸蛋白分析仪(北京凯奥科技发展有限公司);SpectraMAX Plus384型酶标仪(美谷分子仪器有限公司);DZKW-4型电子恒温水浴锅(北京中兴伟业仪器有限公司);UV752N型紫外可见分光光度计(上海佑科仪器仪表有限公司);Leica CM 1950型冷冻切片机(德国Leica公司)。
2 方法
2.1 药物制备
取干燥太白贝母,粉碎成细粉,过5号筛,ig时按大鼠体质量称取川贝母粉,用4 mL无菌水溶解后充分摇匀,形成川贝母粉混悬液,快速ig。
2.2 动物模型的制备及给药
60只SPF级雄性SD大鼠适应性饲养7 d,随机挑选50只大鼠经气管软骨环间隙一次性向气管内缓慢注射含硫酸博莱霉素(5 mg/kg)的无菌水。造模14 d后剔除死亡老鼠,将剩下存活大鼠分为模型组、川贝母高剂量组(FCB-H)、川贝母中剂量组(FCB-M)和川贝母低剂量组(FCB-L),每组8只。大鼠的给药剂量参考《中国药典》2020年版推荐正常成人1~2 g计算,川贝母低、中、高剂量组大鼠每日剂量分别按照人-鼠等效量的0.5、1、2倍给药。从造模后第15天开始ig川贝母粉,高、中、低剂量组分别按每日0.36、0.18、0.09 g/kg剂量连续ig 28 d。空白组大鼠同上法注入无菌水,空白组和模型组正常饮食饮水。
2.3 大鼠样本收集与处理
2.3.1血清样本收集与处理末次给药30 min后,称量体质量,ip戊巴比妥钠,麻醉后仰卧固定于动物解剖台,切开腹腔,用不含抗凝剂的采血管,于腹主动脉取血,室温放置2 h,然后置于4 ℃、2 570 r/min(离心半径12 cm)冷冻离心10 min后分离血清,用于血清细胞因子含量检测。
2.3.2肺组织样本收集与处理切取部分左肺置于4%多聚甲醛溶液中固定24 h以上,石蜡包埋切片,用于苏木素-伊红(HE)、Masson染色分析。另切取部分左肺,置于包埋盒底部,将组织周边涂满包埋胶,锡箔纸包裹置于−80 ℃保存,用于空间代谢组学分析。另切取部分左肺和右肺迅速放入−70 ℃液氮中冻存,用于生化检测和Western blotting分析。
2.4 空间代谢组学分析
对模型组和FCB-M组大鼠肺组织进行空间代谢组学分析。使用切片机对已固定的大鼠肺组织进行纵向切割,并随后进行HE染色。在确定肺纤维化区域的基础上,对与该区域相邻的肺组织进一步切片,用于后续质谱成像扫描分析。分析时,将切片取出后,迅速置于真空干燥器中干燥30 min。质谱成像平台控制程序软件设置扫描参数:X轴扫描速度为0.2 mm/s,Y轴步进间距为0.1 mm,每行延迟时间为7 s,扫描区域的X轴扫描长度为10 mm,Y轴扫描长度为10 mm。数据采集使用Xcalibur 4.4.16软件,依据样本尺寸、步进间距、扫描速度等设定数据采集序列。采用正离子Full MS扫描模式,喷雾电压+5 kV,传输管电压±0 V,毛细管温度350 ℃,扫描范围m/z70~1 000,分辨率60 000,喷雾气压力0.6 MPa,喷雾角度60°,喷雾距切片距离0.7 mm,喷雾距传输管距离3 mm,传输管距锥孔距离10 mm,抽气体积流量45 L/min。
2.5 肺组织差异代谢物的筛选
将质谱原始数据(raw)通过imzMLConverter version 1.3.0软件转换为imzML格式,随后导入到Cardinal软件包(https://bioconductor.org/packages/ release/bioc/html/Cardinal.html)中进行背景扣除、峰值对齐及峰值筛选处理。使用SmetDB数据库和pySM注释框架对通过高分辨质谱成像获得的数据进行代谢物的定性注释。定性标准包括物质峰空间分布得分高于0.9、同位素空间强度得分高于0.1、同位素空间分布得分高于0.1。在此基础上,依据HE染色图,将大鼠肺组织切片分为纤维化区域和非纤维化区域,并选择模型组和FCB-H组肺组织纤维化区域进行对比分析。通过对选取区域质谱数据进行峰数据提取、缺失值填充等处理获得相对定量数据。采用有监督的正交偏最小二乘法判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)获得的VIP值(VIP>1)、T检验的P值(P<0.05)以及差异倍数(fold change,FC)来筛选组间差异代谢产物。采用京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG,https://www.kegg.jp/)对筛选出的差异代谢物进行代谢通路富集分析。
2.6 检测血清及肺组织中相关细胞因子含量
准确称取肺组织质量,加入9倍体积的生理盐水,冰水浴条件下机械匀浆,2 500 r/min离心10 min,取上清液用生理盐水按1∶9稀释成1%组织匀浆,用试剂盒测定HYP含量,使用ELISA试剂盒测定大鼠血清中TGF-β1含量。
2.7 Western blotting检测肺组织中相关蛋白表达
使用Minute动物组织总蛋白提取试剂盒处理肺组织,按照试剂盒说明书进行制样。收集含有总蛋白的样品液并使用BCA法测定蛋白浓度。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜。随后,将膜在室温下用5%脱脂牛奶封闭90 min。分别加入Smad 2、Smad 3、p-Smad 2、p-Smad 3、Akt、p-Akt、E-cadherin和α-SMA一抗,4 ℃孵育4 h;加入二抗,37 ℃孵育1 h;加入增强化学发光试剂进行过氧化物酶标记,采用Chemi Analysis软件测定蛋白条带灰度值,计算目的蛋白相对表达量。
2.8 统计学分析
实验数据均由IBM SPSS Statistics 2.0进行统计分析,两组间比较采用Student’s t检验,多组间统计学差异采用单因素方差分析。
3 结果
3.1 川贝母对大鼠肺组织炎症及纤维化的影响
如图1所示,病理切片HE染色结果显示,空白组大鼠的肺部结构和肺泡构造完好清晰,无明显的炎症细胞浸润和纤维组织增生,几乎未见病理性变化。模型组大鼠的肺泡构造紊乱,间质部位出现大量炎症细胞浸润和纤维组织增生,部分胶原形成了致密的红色胶原沉积,表现出较为明显的纤维化病变。与模型组比较,川贝母各剂量组大鼠肺组织中炎症细胞浸润情况有所减少,胶原纤维相对较少。Masson染色结果显示,空白组大鼠肺组织结构正常,肺泡完整清晰,未见明显的炎症细胞浸润,少量蓝色胶原纤维沉积(大鼠肺部靠近支气管部位有少量纤维化为正常现象)。与空白组比较,模型组大鼠的肺泡构造紊乱,肺组织受到严重破损,存在大量炎症细胞浸润,蓝色胶原纤维沉积较多,纤维化程度严重。与模型组比较,川贝母各剂量给药组大鼠的肺部蓝色胶原纤维沉积和炎症细胞浸润明显减少,纤维化程度均有所减轻。
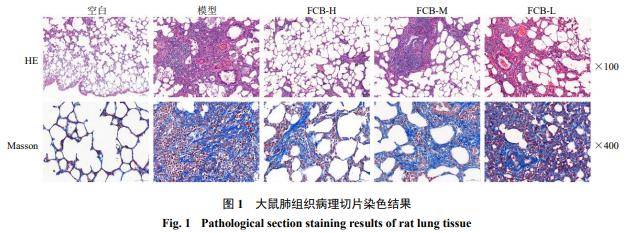
3.2 空间代谢组学分析结果
3.2.1肺组织空间代谢组学轮廓分析结果运用空气动力辅助解吸电喷雾离子化质谱成像技术对大鼠肺组织样本进行空间代谢组学分析。在正离子模式下对肺组织扫描分析后,对扫描数据进行空间收缩质心聚类分析,然后进行K-means聚类,共识别出12个不同的代谢物簇,见图2-A。值得注意的是,其中一些特定簇的分布与纤维化区域表现出了明显的相关性。通过HE染色图分析,确定模型组和FCB-M组肺组织上纤维化病灶区域,用于代谢组学对比分析。分别采用有监督的主成分分析(principal component analysis,PCA)、偏最小二乘判别分析(partial least squares-discriminant analysis,PLS-DA)及OPLS-DA进行多元数据分析。PCA结果显示,模型组和FCB-M组的样本在无监督模式下表现出良好的聚类特性,且两者之间存在显着的区分,见图2-B。同样,PLS-DA的结果展示了模型组与FCB-M组之间的明显分离,且模型的解释率R2Y(cum)和预测率Q2(cum)均接近1,表明模型具有良好的预测能力,见图2-C。OPLS-DA结果显示,模型组和FCB-M样本在得分图上具有显著的差异,见图2-D。根据OPLS-DA模型得到变量权重值(variable importance of projection,VIP)用于后续潜在的生物标记物的寻找。为防止模型出现过拟合现象,采取了7轮交叉验证以及200次响应排序检验的方法来评估模型的性能。R2和Q2的值从左至右均低于最右侧的原始值,且Q2与Y轴在负半轴上交叉,表明实验的模型没有出现过拟合现象,预测能力表现良好,见图2-E。

3.2.2相关差异代谢物筛选结果基于OPLS-DA的V-plots得分图,选取VIP>1且P<0.05的指标,筛选出模型组与给药组间比较分析出的显著差异的代谢产物,共筛选并鉴定出71种差异代谢物(图3-A、B)。图中,红点表示实验组中显著上调的代谢产物,蓝点表示显著下调的代谢产物,灰点则代表不显著的代谢产物,筛选后的差异代谢物热图见图3-C。与模型组比较,FCB-M组肺组织纤维化区域中,精胺、亚精胺等25个代谢物显著上调,L-精氨酸、2-甲氧基雌二醇等46个差异代谢物显著下调。
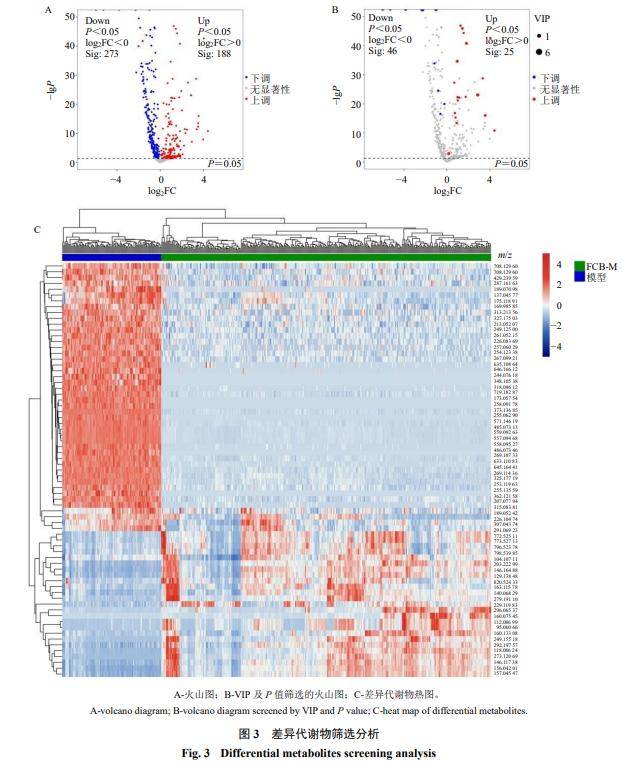
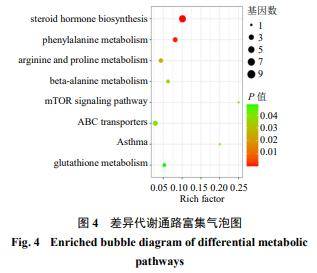
3.2.3差异代谢通路分析结果利用模型组和FCB-M组比较筛选得到的71个差异代谢物的KEGG ID进行通路富集分析。应用超几何检验,在显著性差异表达代谢物中显著富集的通路条目,共富集到8条可能的代谢通路,代谢通路气泡图见图4,结合课题组前期的实验结果及文献报道,从中筛选出4条可能与肺纤维化相关的代谢通路,分别为精氨酸和脯氨酸代谢途径、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路、谷胱甘肽代谢途径、类固醇激素生物合成途径。这些途径中共涉及13个关键的差异代谢物,其中L-精氨酸(m/z 175.118 9)、精胺(m/z203.223 0)、亚精胺(m/z146.164 9)和2-甲氧基雌二醇(m/z 325.177 2)4个内源性差异代谢物在大鼠肺组织上的质谱成像图见图5。

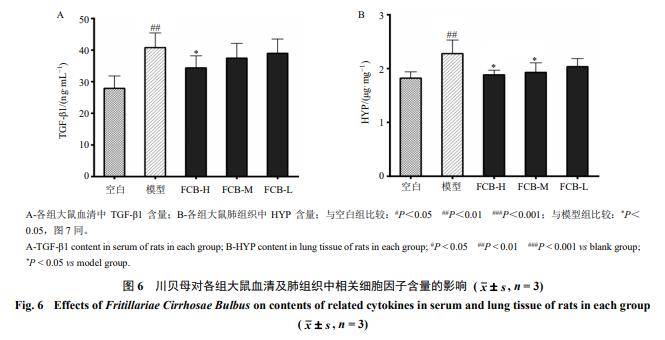
3.3川贝母对大鼠血清中TGF-β1及肺组织中HYP水平的影响
如图6所示,与空白组比较,模型组大鼠血清中TGF-β1和肺组织中HYP含量均明显升高(P<0.01);连续28 d ig不同剂量川贝母粉后,与模型组比较,FCB-H组大鼠血清中TGF-β1显著降低(P<0.05),FCB-H、FCB-M组肺组织中HYP含量显著降低(P<0.05)。结果表明,川贝母粉能够调控博来霉素诱导的肺纤维化大鼠体内TGF-β1和HYP的表达。
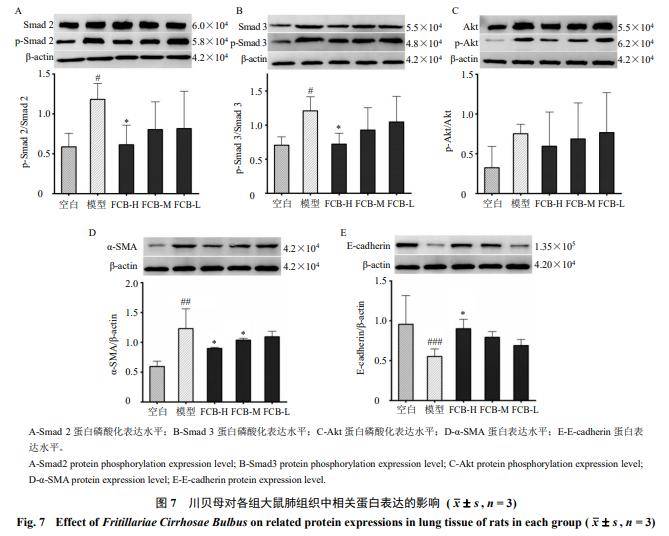
3.4 川贝母对大鼠肺组织中肺纤维化相关蛋白表达的影响
如图7所示,与空白组比较,模型组大鼠肺组织中E-cadherin蛋白表达水平显著降低(P<0.001),Smad 2、Smad 3的磷酸化水平和α-SMA蛋白表达水平显著升高(P<0.05、0.01),p-Akt/Akt蛋白表达量升高;与模型组比较,FCB-H组大鼠肺组织中Smad 2和Smad 3磷酸化水平显著降低(P<0.05),E-cadherin蛋白表达水平显著升高(P<0.05);FCB-H组和FCB-M组α-SMA蛋白表达水平显著降低(P<0.05),各给药组p-Akt/Akt蛋白表达量有降低趋势。结果表明,川贝母粉能够调控博来霉素诱导的肺纤维化大鼠体内TGF-β1/Smad 2/3信号通路和EMT相关蛋白表达。
4 讨论
为了探寻川贝母抗肺纤维化可能的药理作用机制,本研究先利用空间代谢组学结合多变量统计分析,从不同给药组对比筛选出与川贝母抗肺纤维化可能的相关代谢通路,再利用常规药理实验对其中一些相关性强的代谢通路进行验证。差异代谢通路富集分析结果显示川贝母可能是通过调控mTOR、精氨酸、脯氨酸和谷胱甘肽等代谢途径发挥抗肺纤维化作用。越来越多的研究发现肺纤维化过程中会出现mTOR信号通路过度活化,抑制该信号通路可以抑制EMT和减少细胞外基质的表达,从而抑制纤维化形成[18-20]。EMT是一种完全分化的上皮细胞在外界因素作用下逐渐转变为间充质细胞,并失去上皮细胞原有功能的过程,是肺纤维化发生和发展的重要机制[21]。在EMT过程中,上皮细胞标志物如E-cadherin、紧密黏连蛋白-1等表达降低,间质细胞标志物如α-SMA、成纤维细胞特异蛋白等表达升高。研究表明,L-精氨酸是mTOR信号通路中一个重要的调节因子,L-精氨酸的摄入可以增加细胞内的蛋白质合成速率,增加氨基酸传感器的表达,从而激活mTOR信号通路调控EMT阶段[22-23]。本研究中质谱成像结果显示,肺纤维化大鼠给药川贝母粉28 d后,其肺组织纤维化区域的L-精氨酸含量明显低于模型组大鼠肺纤维化区域中L-精氨酸含量,表明在肺纤维化模型基础上,给药川贝母会影响大鼠体内L-精氨酸含量水平,从而调控EMT阶段。此外,Akt是mTOR信号通路中的关键靶点,mTOR复合物可以通过直接磷酸化激活Akt,调控细胞的肌动蛋白骨架,从而调控EMT[24-25]。TGF-β1被认为是肺纤维化发生的核心因素[26]。当TGF-β1/Smad信号通路被激活时,会导致减少上皮细胞标志物(如E-cadherin)的表达,并增加间质细胞标志物(如α-SMA)的表达,从而促进EMT过程[27-28]。细胞因子检测结果显示,与模型组比较,FCB-H组能够明显抑制由博来霉素引起的TGF-β1升高。Western blotting分析结果显示,与模型组比较,FCB-H组大鼠肺组织中α-SMA、p-Akt表达量降低,E-cadherin表达量升高,Smad 2和Smad 3磷酸化水平降低。表明川贝母可能通过TGF-β1/Smad和Akt/mTOR等信号通路来抑制EMT,从而发挥抗肺纤维化作用。
此外,空间代谢组学分析结果显示,川贝母抗肺纤维化还可能与抑制细胞外基质沉积有关。细胞外基质是组织中的非细胞部分,主要由胶原蛋白、纤维连接蛋白等多种蛋白质和多糖组成。研究表明,细胞外基质的沉积在肺纤维化的发展过程中起着重要作用,是肺纤维化的主要病理特征之一[29]。精氨酸和脯氨酸代谢是人体内重要的代谢途径,在蛋白质合成和多种信号传导途径各种生物化学过程中发挥关键作用。脯氨酸参与胶原蛋白的合成,其代谢异常可能会影响到胶原蛋白的产生,进而导致细胞外基质沉积[30]。亚精胺是精氨酸和脯氨酸代谢途径的主要产物之一,在衰老、细胞自噬等领域都有重要的生理功能。研究表明,亚精胺会导致纤维化小鼠细胞外基质相关蛋白表达水平明显下降,从而起到抗纤维化的作用[31]。质谱成像结果显示,肺纤维化大鼠给药川贝母粉28 d后,其肺组织纤维化区域的亚精胺含量明显高于模型组大鼠肺纤维化区域中亚精胺含量。HYP是胶原蛋白的主要组成成分,而胶原蛋白是细胞外基质的核心组成部分,因此HYP常被当作评估肺纤维化程度及其疾病进展的生物标志物[32]。细胞因子检测结果显示,与模型组比较,FCB-H、FCB-M组均能够明显抑制由博来霉素引起的HYP升高的情况。此外,病理切片分析结果显示,与模型组比较,给药川贝母后大鼠肺组织蓝色胶原纤维沉积明显减少,表明川贝母可能是通过调控与细胞外基质沉积相关的代谢途径来发挥抗肺纤维化作用。
综上,川贝母粉能够在一定程度上改善博来霉素诱导的大鼠肺纤维化,其作用机制可能是通过调控EMT阶段、抑制细胞外基质沉积等途径来实现的。本研究基于空间代谢组学技术初步研究了川贝母抗肺纤维化的药理作用机制,为川贝母抗肺纤维化研究提供了一些参考。
利益冲突所有作者均声明不存在利益冲突
参考文献(略)
来 源:秦善博,谭 鹏,郝 露,谢俊杰,林俊芝,张 磊,赵军宁.基于空间代谢组学探究川贝母抗肺纤维化的作用机制(II) [J]. 中草药, 2024, 55(2): 479-488.
- 本文固定链接: https://maimengkong.com/zixun/1730.html
- 转载请注明: : 萌小白 2024年5月3日 于 卖萌控的博客 发表
- 百度已收录
